Czy stała nadekspresja genów, wprowadzona poprzez system lentiwirusowy, jest wciąż popularnym narzędziem biotechnologów?
22 Sierpnia 2023 (Ostatnia aktualizacja 22.10.2024)
Okazuje się, że tak! Systemy ekspresji lentiwirusów stały się aktualnie nawet kluczowym narzędziem w temacie terapii genowej, oferując naukowcom możliwość wprowadzania genów terapeutycznych do komórek gospodarza. Technologia ta powstała w latach 80 XX wieku i od tego czasu przeszła znaczący rozwój, naznaczony czterema generacjami systemów lentiwirusowych. Przyjrzyjmy się tej ewolucji.

Spis:
- Na czym w ogóle polega lentiwirusowy system transferu genów (lentivirus transduction system)? (Podstawowe pojęcia; kolejne etapy protokołu)
- Współczesny system lentiwirusowy - szlifowanie wydajnego, biotechnologicznego narzędzia transferu genów (Systemy 1-wszej, 2-giej, 3-ciej i 4-tej generacji)
- Przykłady terapii genowej człowieka (CAR-T) (Badania na świecie i w Polsce)
- Wybrane wyzwania napotkane podczas przygotowania terapii z wykorzystaniem limfocytów T (Jak zwiększyć liczbę limfocytów CD3+ CD8+ oraz utrzymać ich naiwny fenotyp?; GMP?)
Na czym polega lentiwirusowy system transferu genów (lentivirus transduction system)?
Na początku warto nieco przybliżyć sam system. Sposób jego działania, konstrukcję, workflow/protokół eksperymentalny i podstawowe pojęcia. Lentiwirusy (lentiviruses) to wirusy z rodziny retrowirusów, także używanych jako narzędzie biotechnologiczne. W odróżnieniu jednak od tych pierwszych mogą transdukować jedynie dzielące się komórki. Materiałem generycznym obu jest RNA, które aby mogło być wintegrowane do DNA komórki ssaczej musi być najpierw przepisane na DNA poprzez odwrotną transkrypcję.
Typowo dla wirusów, system lentiwirusowy (lentivirus transduction system) wykorzystuje wektory wirusowe = cząstki wirusowe, mające zdolność wprowadzać materiał genetyczny do wnętrza komórek infekowanych = docelowych. W warunkach doświadczalnych, taka celowa infekcja wektorami wirusowymi to transdukcja wirusowa (viral transduction). Aby ją przeprowadzić trzeba najpierw wytworzyć „sztucznie” lentiwirusy.
Etapy przygotowania cząstek lentiwirusowych/ wektorów lentiwirusowych (lentiviral workflow):
- 1. należy wybrać odpowiedni transgen który chcemy nadeksprymować (gen docelowy = gen transferowy (gene of interest, GOI, target gene),
- 2. wybrać odpowiedni lentiwirusowy system transferu genów (gene transfer system), w tym m.in.:
- generację systemu lentiwirusowego (o tym w dalszej części opracowania)
- tropizm wiążący się z "kopertą" lentiwirusową, czyli " składem otoczki" okalającej cząstkę wirusową (lentiviral envelope). Zazwyczaj wyróżnia się 2 typy- pseudotyp o szerokim tropizmie tj. infekcyjności VSV-G (Vesicular stomatitis virus Glycoprotein) oraz pseudotyp ekotropowy mający potencjał do transdukcji komórek gryzoni (MLV ecotropic envelope glycoprotein)
- 3. wklonować gen docelowy tj. GOI (gene of interest) w wybrane wektory plazmidowe (plasmid) zawierające
- odpowiednie markery (np. gen oporności na puromycynę, hygromycynę, neomycynę i/lub białko fluorescencyjne)
- oraz promotor (CMV, EF-1alfa, Tet). Warto przy tym pamiętać, że kapsyd lentiwirusa może transportować jedynie 9,7 kb pomiędzy fragmentami długich terminalych powtórzeń czyli LTR (long terminal repeat), co zawęża wielkość insertu (orf) do 2,5-5 kb.
- 4. pozyskane wektory plazmidowe transfekować do tzw. komórek pakujących (packaging cells), służących do składania wektorów lentiwirusowych (np. HEC293T). Nie są one komórkami docelowymi transferu genów, służą jako małe fabryki wektorów wirusowych. Na terenie ich cytoplazmy dochodzi do ekspresji elementów lentiwirusowych zakodowanych w kasetach oraz do składania lentiwirusów.
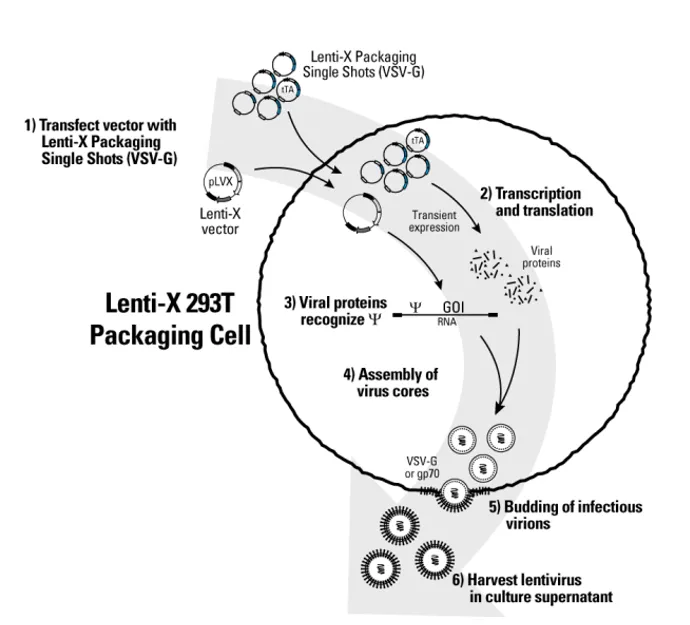
Fig 1. Etapy produkcji lentiwirusów [źródło takarabio .com]
- 5. hodować komórki przez 48-72 h. W tym czasie dochodzi do składania wektorów lentiwirusowych (lentivirus vectors), ich dojrzewania i wybłaniania do przestrzeni zewnątrzkomórkowej. Na początku cząstki mogą nie zawierać materiału RNA lub esencjonalnych enzymów czy białek. Z czasem zależnym od efektywności zintegrowanych mechanizmów dochodzi do tworzenia w pełni funkcjonalnych wektorów wirusowych, które poprzez błonę komórkową komórek pakujących wydostają się do medium hodowlanego. Warto brać to pod uwagę podczas kolejnego kroku.
- 6. ocenić ilość uwolnionych cząstek, czyli określić miano titracyjne. Można tego dokonać poprzez:
- RT-qPCR (pamiętając, że materiałem genetycznym jest RNA),
- pomiar stężenia glikoproteiny otoczki poprzez np. ELISĘ,
- ocenić efektywność transdukcji cząstek, przeprowadzając doświadczenie pilotażowe na innych niż docelowych komórkach i sprawdzając ilość wprowadzonego markeru/sekwencji.
Ten etap potrzebny jest, aby posługiwać się w transdukcji MOI (Multiplicity Of Infection), czyli liczbą wektorów wirusowych przypadających na jedną transdukowaną komórkę.
A

B
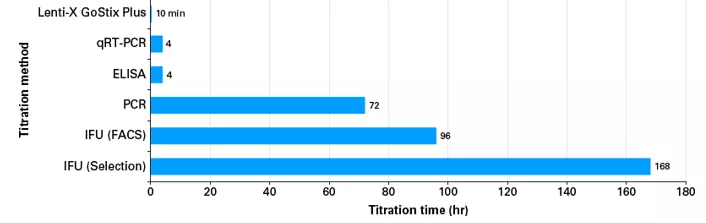
Fig.2 Rodzaje metod titracji (miareczkowania) lentiwirusów
Panel A. Postaci lentiwirusów obecne w supernatantach. Metody pomiaru mogą obejmować analizę zarówno funkcjonalnych, jak i niefunkcjonalnych cząstek, a także wolnych białek kapsydu (np. p24) uwalnianych do pożywki np. wraz ze śmiercią komórek pakujących. Metody miareczkowania funkcjonalnego zaś obejmują w szczególności pomiar funkcjonalnych cząstek wirusa. Panel B. Czas trwania metod titracji. Lenti-X GoStix Plus: metoda oparta na kasetkowym teście ELISA do wykrywania lentiwirusowego p24 w supernatantach. qRT-PCR: kwantyfikacja wirusowego materiału RNA za pomocą qRT-PCR. Klasyczny test ELISA: pomiar ilości białka kapsydu p24. PCR: wykrywanie zintegrowanych prowirusów DNA metodą qPCR. IFU (FACS): określenie odsetka zainfekowanych komórek poprzez analizę FACS komórek RFP/GFP dodatnich. IFU (selekcja): jednostki zakaźne określone ilościowo przez określenie liczby kolonii opornych na antybiotyki w transdukowanych populacjach. [źródło takarabio .com]
- 7. wyizolować i/lub skoncentrować wektory lentiwirusowe. Jeśli cząstki podawane są do organizmu ssaka np. podczas terapii genowej, sugeruje się dokładniejsze podczyszczenie, aby nie wywołać reakcji układu immunologicznego. Punkt 6 z 7 mogą być zamieniane.
- 8. zaaplikować cząstki zgodnie z wybranym MOI (najczęściej w przedziale 5-100) na hodowlę komórek docelowych w obecności dodatkowego enhancera wnikania. Łatwiej ulegają transdukcji komórki adherentne, na które wektory wirusowe mogą swobodnie opaść. Często etap ten trwa przez noc (ok 16-18h). W tym czasie z kapsydu wirusa uwalniane jest RNA, które następie po przepisaniu na DNA, transportowane jest do jądra komórkowego i dzięki aktywności enzymatycznej integrazy włączane w genom zainfekowanej komórki. Zależnie od promotora kaseta ulega transkrypcji i translacji jak integralny materiał "gospodarza".
- 9. zbadać efektywność transdukcji poprzez pomiar ekspresji genów markerowych lub samego transgenu. Podczas pracy z hodowlami komórkowymi łatwiej tego dokonać na bieżąco. Można też wybrać sposób pracy (prowadzenia eksperymentów)
- z populacją komórek transdukowanych lub
- na serii klonów. Drugi sposób możliwy jest jedynie podczas pracy z liniami komórkowymi, czyli unieśmiertelnionymi komórkami, podlagającymi podziałom prawie bez ograniczeń. Należy pamiętać, że obserwowane wyniki doświadczeń przeprowadzonych na klonach mogą być obciążone zjawiskiem podobnym do izolacji geograficznej u zwierząt. Gen transferowy losowo integruje w genom transdukowanych komórek. Oznacza to, że mógł uszkodzić zapis białka wykonawczego mającego poważne efekty fenotypowe, które możemy pomylić z wynikami prowadzonej nadekspresji. Dlatego warto np. przy wyprowadzaniu hodowli modelowej, stworzyć kilka klonów na których będzie się przeprowadzać doświadczenia (tzw. replikaty biologiczne) oraz określić miejsce integracji kasety lentiwirusowej np. poprzez genome walking.
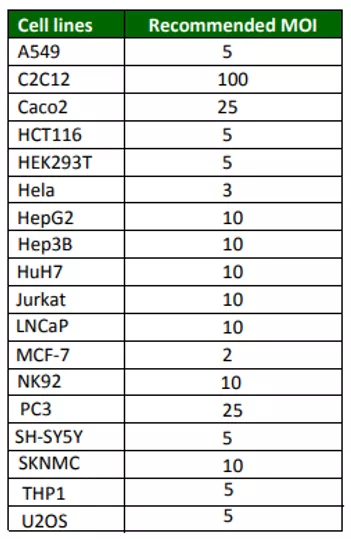
Fig.3 Przykładowe MOI dla linii komórkowych [źródło origene .com]
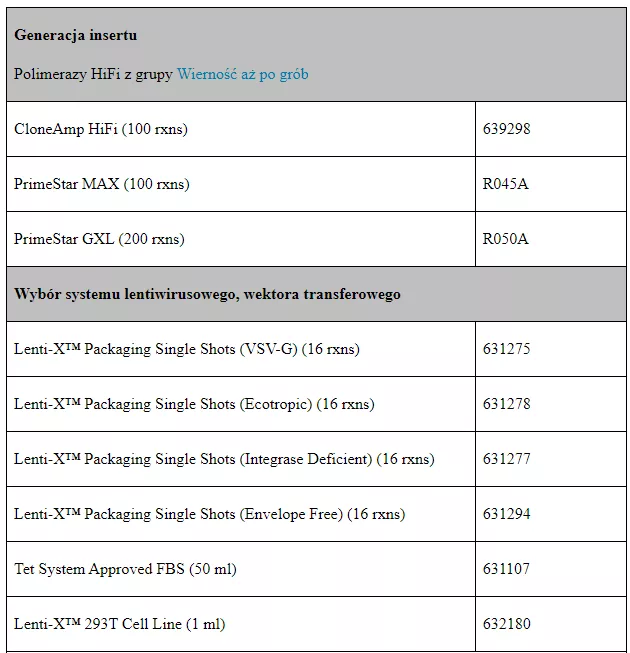
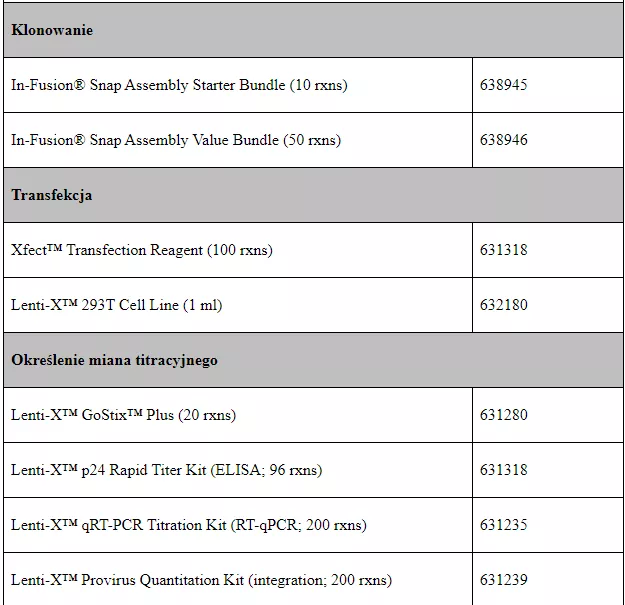
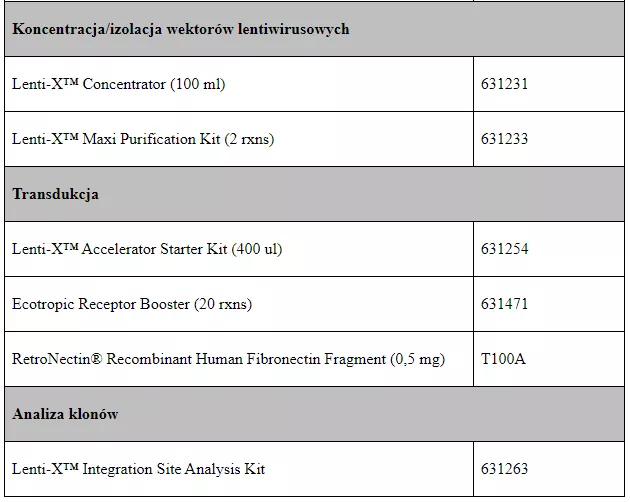
Tabela 1 zestawiająca dostępne w naszej ofercie produkty z podziałem na etapy protokołu.
Trifold Protein On/Off
Broszura Lenti-X
Współczesny system lentiwirusowy - szlifowanie wydajnego, biotechnologicznego narzędzia transferu genów
System lentiwirusowy 1-wszej generacji
Wektory lentiwirusowe pierwszej generacji, oparte na HIV-1, zapewniały niezaprzeczalną zdolność do stabilnej integracji materiału genetycznego z genomem nie dzielących się komórek. Stanowiły jednak również niebezpieczeństwo, jako wczesne, niedoskonałe narzędzie. Zawierały wiele genów wt (wild type) pochodzących od wirusów w niezmienionej formie i uszeregowaniu. Wiązało się to ze zwiększonym zagrożeniem w pracy, ponieważ w miarę produkcji często dochodziło do generowania lentiwirusów zdolnych do autoreplikacji RCL (Replication competent lentiviruses). Tzn. powstałe cząstki miały zdolności do niegraniczonego i niekontrolowanego replikowania się w zarażonych komórkach prowadząc do ich śmierci. Stanowiło to poważne zagrożenie dla bezpieczeństwa biologicznego oraz nie mogło być wykorzystywane jako narzędzie to transfekcji stałej i kolejnych eksperymentów zarówno w hodowlach jak i organizmach modelowych. Z tych względów system pierwszej generacji nie jest już używany.
System lentiwirusowy 2-giej generacji
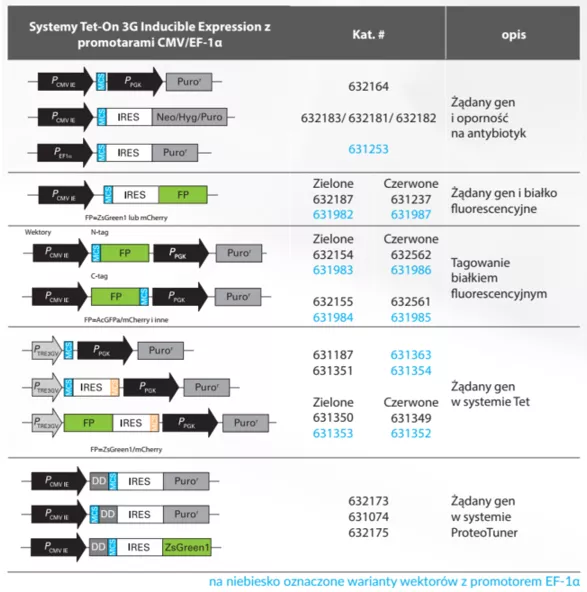
Będąc świadomym ryzyka związanego z systemem pierwszej generacji, naukowcy rozpoczęli udoskonalanie technologii. Doprowadziło to do stworzenia systemu ekspresji lentiwirusów drugiej generacji. W tym przypadku głównym ulepszeniem był podział niezbędnych składników wirusowych na oddzielne plazmidy, drastycznie zmniejszając prawdopodobieństwo wytworzenia RCL. Systemy drugiej generacji utrzymywały kasety env, oraz gag-pol na oddzielnych plazmidach, niezbędne sekwencje cis oraz transgen były umieszczone w wektorze transferowym (Fig.4). Rozwój ten sprawił, że systemy lentiwirusowe stały się znacznie bezpieczniejsze, bez poświęcania ich wydajności oraz szerokiego tropizmu komórkowego.
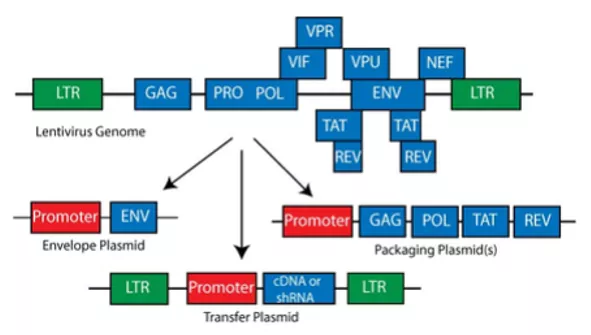
Fig.4 Skład kaset systemu lentiwirusowego 2giej generacji [źródło addgene .org]
System lentiwirusowy 3-ciej generacji
Dalsze postępy przyniosły systemy ekspresji lentiwirusów trzeciej generacji. System ten znacząco zwiększył bezpieczeństwo nie tylko poprzez separację kaset, ale także poprzez usunięcie wszystkich niepotrzebnych wirusowych genów pomocniczych, takich jak vif, vpr, vpu i nef z plazmidów pakujących. Ponadto, ograniczono w nim stopień nakładania się sekwencji wszystko w celu zapobiegania losowym zdarzeniom rekombinacji i zastosowano jedynie promotory konstytutywne CMV. Dodatkowo, białko otoczki zostało zmienione na białko nie wirusowe, co dodatkowo zwiększyło bezpieczeństwo.
Ulepszony profil bezpieczeństwa biologicznego i utrzymana zdolność do transdukcji nie dzielących się komórek sprawiły, że systemy trzeciej generacji stały się bardziej popularne w środowisku badawczym niż wirusy 2-giej generacji.
Istotnym aspektem systemów ekspresji lentiwirusów jest konstrukcja wektora/palzmidu. Plazmidy lentiwirusowe to koliste cząsteczki DNA przenoszące materiał genetyczny, który ma zostać dostarczony do komórek docelowych. Są one zaprojektowane tak, aby zawierały regiony promotorowe, sygnały poliadenylacji, miejsca klonowania do wstawiania genu transferowego (MCS, multiple cloning site) i inne elementy regulacyjne do kontrolowanej ekspresji wstawionego genu. Geny białka otoczki (env), które określają tropizm wirusa, mogą być modyfikowane w celu skierowania wirusa do określonych typów komórek, zwiększając tym samym specyficzność systemu.
Ponadto, do wektora można włączyć różne elementy genetyczne, takie jak enhancery, silencery i regiony przyłączania rusztowania/matrycy (S/MAR), aby regulować ekspresję transgenu i izolować sekwencje od wpływu otaczającej chromatyny po integracji. Można również dołączyć elementy bezpieczeństwa, takie jak geny samobójcze, umożliwiające anihilację transdukowanych komórek w przypadku wystąpienia zdarzeń niepożądanych.
W ostatnich latach, popularne są samo-inaktywujące się lentiwirusowe wektory transferowe tzw. SIN (self-inactivating), które mają delecje w regionie U3 długiego LTR 3'. W czasie odwrotnej transkrypcji i integracji z genomem komórki gospodarza, LTRy są kopiowane i okalają kasetę transgenu. Zawierają w swoim składzie liczne sekwencje dla czynników transkrypcyjnych. Delecja w tym obszarze zmniejsza prawdopodobieństwo niekontrolowanej transkrypcji i potencjalnej aktywacji protoonkogenów oraz mutagenezy insercyjnej.
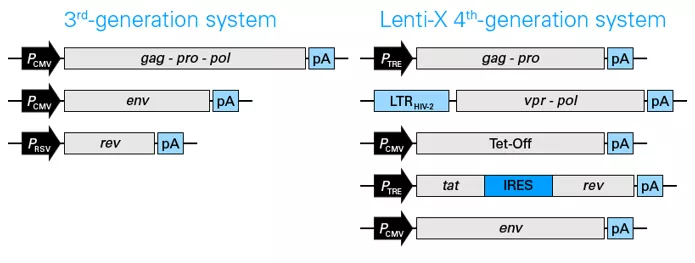
Fig.5 Skład kaset systemu lentiwirusowego 3ciej i 4tej generacji.
Na grafie nie uwzględniono wektora transferowego. Elementy kodują odpowiednio:
- gag- strukturę lentiwirusa (białka macierzy, kapsyd, nukleokapsyd)
- pro- proteazę
- pol- białka potrzebne do integracji - polimerazę I integrazę
- env- glikoproteinę otoczki zapewniająca tropizm wirusów
- rev- białko wiążące się z RRE (Rev Response Element) umożliwiające eksport z jądra komórkowego
- vpr- sygnał enkapsulacji
- Tet-Off- transaktywator systemu TetOff
- tat- białko wiążące się z elementem TAR, aby aktywować transkrypcję z promotora wirusowego w LTR
- IRES -sygnał przyłączania się rybosomu i tworzenia niezależnego transktyptu (internal ribosome entry site)
[źródło takarabio .com]
System lentiwirusowy 4-tej generacji
Na rynku istnieje jeszcze jeden system leniwirusowy, stworzony przez firmę TakaraBio - System czwartej generacji Lenti-X.
Uważany jest za lepszy niż system 3-ciej generacji, ponieważ rozwija i wzmacnia strategię rozdzielania genów wirusowych, która zmniejsza ryzyko generowania lentiwirusów RCL zdolnych do niekontrolowanej autoreplikacji w komórkach docelowych. System Lenti-X wykorzystuje aż 5 wektorów pakujących. W rezultacie czego gag, pol i env znajdują się na trzech fizycznie odrębnych jednostkach, a nie na dwóch. Stworzenie więc wirusów RCL wymaga dużo większej liczby zdarzeń rekombinacji i jest jeszcze mniej prawdopodobne.
Ponadto, kasetę gag-pro-pol kodującą białka macierzy wirusa oraz esencjonalne enzymy (integrazę oraz odwrotną transkryptazę) podzielono i odseparowano od siebie zwiększając bezpieczeństwo (Wu, X. et al. (2000) Mol. Ther. 2(1):47–55; PMID: 10899827).
System Lenti-X zoptymalizowano także pod kątem wydajności tworzenia funkcjonalnych lentiwirusów, łatwości użytkowania i bezpieczeństwa. Umożliwia on wytwarzanie bardzo wysokiego miana lentiwirusów (10^7-10^8 IFU/ml) oraz jest jednym z najpopularniejszych dostępnych na rynku systemów pakowania lentiwirusowego.
Na zwiększenie funkcjonalności wektorów lentiwirusowych miało wpływ umieszczenie kasety pol wraz z elementem vpr zwiększającym prawdopodobieństwo zapakowania odwrotnej transkryptazy i integrazy do wewnątrz cząstki lentiwirusowej, co zwiększyło skuteczność transdukcji.
Ponadto, jako promotory użyte są - nie tylko konstytutywny CMV ale i TRE- czyli, promotor systemu indukowanego Tet (TetOFF). Użycie tej technologii nie pozwala na wyciszenie syntezy kaset gag-pro, tat//rev, a w konsekwencji kaset vpr-pol, zwiększając liczbę wytwarzanych cząstek (Fig.6). Należy pamiętać, że niezbędne jest użycie w hodowli komórek pakujących specjalnej surowicy bez tetracyklin, inhibujących działanie transaktywatora. Obecność sekwencji LTR sprawia, że wydajniej z systemem będą pracować plazmidy transferowe z LTRami WT (Fig.8).
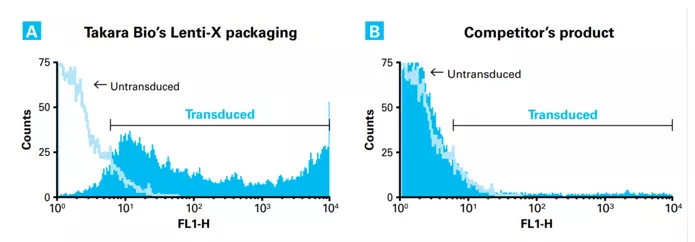
Fig.6 Wydajność tworzenia sprawnych cząstek Lentiwirusowych
System pakowania Lenti-X (panel A) i konkurencyjny system 3ciej generacji (panel B) zostały użyte z komórkami Lenti-X 293T do wygenerowania wektorów lentiwirusowych, niosących białko fluorescencyjne ZsGreen1. Supernatant wykorzystano do transdukcji komórek HeLa. 10 µl reakcji pakowania Lenti-X było w stanie transdukować więcej komórek niż 10 µl supernatantu konkurenta. [źródło takarabio .com]
Inną cenną zaletą systemu jest format, wpływający na łatwość użytkowania. Komponenty systemu pakowane są jako liofilizat w fiolki na zasadzie 1 fiolka jedna produkcja wirusa. Chroni to przed ryzykiem kontaminacji, oraz jest gwarantem niezmienionej struktury plamidów i ich optymalnych proporcji. Fiolki ponadto zawierają także medium do transfekcji komórek pakujących - Xfect.
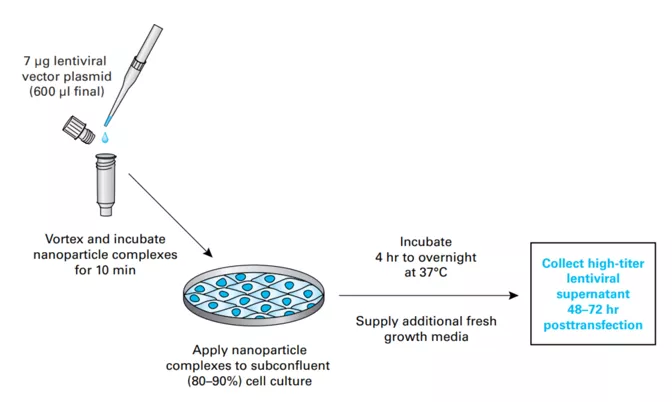
Fig.7 Protokół Lenti-X single shots [źródło takarabio .com]
Nie zawierają zaś wektora transferowego, do którego trzeba wklonować wybraną sekwencję np. gen terapeutyczny. Plazmidem transferowym może być każdy plazmid lentiwirusowy pochodzenia HIV-1 (Fig.8).

Fig.8 Za pomocą Lenti-x wyprodukowano wirusy o wysokim mianie titracyjnym niezależnie od szkieletu wektora lentiwirusowego.
Kaseta ekspresyjna CMV ZsGreen1 została wklonowana do kilku szkieletów wektorów lentiwirusowych. Wektory te zostały następnie spakowane do lentiwirusa przy użyciu systemu Lenti-X single shots zgodnie z protokołem. Następnie mieszaninę dodawano do hodowanych komórek Lenti-X 293T, które były w 80% konfluentne. Po 48 godzinach określono miano wirusa przy użyciu kilku metod. Aby określić zakaźność, supernatant zebrano i wykorzystano do zainfekowania komórek HT1080 (cytometria przepływowa). Zebrane supernatanty wirusowe analizowano również metodą RT-qPCR w celu ilościowego określenia kopii genomu wirusowego (qRT-PCR, Lenti-X qRT-PCR Titration Kit), ELISA w celu pomiaru p24 (p24 ELISA, Lenti-X p24 Rapid Titer Kit) oraz metodą szybkiego wykrywania lentiwirusów (Lenti-X GoStix). [źródło takarabio .com]
Zastosowanie wszystkich opisanych modyfikacji pozwala na większe niż w systemie 3-ciej generacji produkowanie cząstek lentiwirusowych (25x) oraz zwiększenie ich niezawodności (pełnej skuteczności i kompletności). Przekłada się to na otrzymanie większego uzysku cząstek faktycznie niosących cargo, zdolnych do transdukcji, już po 48h.
Lenti-x zapewniają także powtarzalność uzysku wektorów lentiwirusowych.
Tabela 2. zestawiająca dostępne w naszej ofercie produkty Lenti-X Packaging Single Shots
| Lenti-X™ Packaging Single Shots (VSV-G) (16 rxns) | 631275 |
| Lenti-X™ Packaging Single Shots (Ecotropic) (16 rxns) | 631278 |
| Lenti-X™ Packaging Single Shots (Integrase Deficient) (16 rxns) | 631277 |
| Lenti-X™ Packaging Single Shots (Envelope Free) (16 rxns) | 631294 |
| Tet System Approved FBS (50 ml) | 631107 |
Podsumowując, systemy ekspresji lentiwirusów znacznie ewoluowały od czasu ich powstania, a każda generacja przynosi poprawę bezpieczeństwa i wydajności. Staranne zaprojektowanie wektorów pozwala na ukierunkowane i kontrolowane dostarczanie materiału genetycznego, czyniąc te systemy potężnym narzędziem w terapii genowej i badaniach biotechnologicznych.
Przykłady terapii genowej człowieka (CAR-T)
Pierwszą na świecie potwierdzoną klinicznie terapią genową (gene therapy) CAR-T czyli terapią limfocytami T z chimerycznymi receptorami antygenów (chimeric antigen receptor, CAR) była kuracja lekiem Kymriah (tisagenlecleucel). Jest on przeznaczony do terapii genowej chorób młodych pacjentów pediatrycznych z ostrą białaczka limfoblastyczną ALL (B-cell precursor acute lymphoblastic leukemia). Choroba należy do grupy chorób hematoonkologicznych polegającą na gwałtownym rozroście komórek prekursorowych limfocytów B, w konsekwencji czego dochodzi do hamowania prawidłowych funkcji szpiku. Choroba stanowi ok. 80% wszystkich białaczek u dzieci.
Do zatwierdzenia terapii doszło 2 maja 2018 roku, kiedy amerykańska agencja FDA (Food and Drug Administration) potwierdziła jego skuteczność w leczeniu pacjentów z nawrotowym lub opornym (R/R) chłoniakiem dużych limfocytów B, w tym z chłoniakiem rozlanym DLBCL (diffuse large B-cell lymphoma). W badaniach klinicznych terapii genowej II fazy brało udział 68 pacjentów o złych rokowaniach R/R i DLBCL. Wyniki wskazały obiektywny wskaźnik odpowiedzi (ORR; objective response rate) na poziomie 50%, przy czym w 32% przypadków osiągnięto całkowitą odpowiedź.
Z kolei pierwszą w Europie zatwierdzoną terapią była ta z zastosowaniem preparatu Yescarta, leczącego to samo schorzenie (koniec 2018). Środek był testowany na 101 pacjantach z przewagą chorych na DLBCL. Wynik przewyższył Kymriah z odpowiedzią ORR na poziomie 82% (całkowita odpowiedź 49%) (pharmaceutical-technology .com).
Aktualnie terapia genowa zarówno preparatem Yescarta jak i Kymriah jest zatwierdzona w Unii Europejskiej i USA. Pojawiły się też leki kolejnych generacji dla chorych na białaczki (ALL, NHL, MCL).
Warto w tym miejscu wspomnieć, że podwaliny do opracowania terapii podłożył już w 1992 roku Michel Sadelain, który za pomocą wektora retrowirusowego wprowadził geny CAR do limfocytów T.
Na czym polega terapia genowa TCAR?
Zatwierdzone terapie polegają na pobraniu od pacjentów limfocytów T , transdukcji wirusowej która powoduje długotrwałą ekspresję genów, hodowli i namnożeniu zmienionych komórek (CAR-T) oraz podaniu ich ponownie pacjentowi. Zmienione komórki, prowadzące ekspresję genu terapeutycznego są preparatem leczniczym. Wprowadzony chimeryczny receptor (CAR) rozpoznaje antygeny obecne na powierzchni docelowych komórek nowotworowych, niezależnie od ograniczeń głównego układu zgodności tkankowej (MHC, major histocompatibility complex), prowadząc do ich zniszczenia. CAR zazwyczaj składają się z domeny zewnątrzkomórkowej - jednołańcuchowego zmiennego fragmentu przeciwciała monoklonalnego zaangażowanego w rozpoznawanie antygenu komórki docelowej (scFv)- oraz domeny wewnątrzkomórkowej odpowiedzialnej za aktywację i indukcję śmierci komórkowej.
W przypadku dwóch opisanych powyżej terapii dochodzi do wykorzystania genów kodujących receptor TCR (T-cell receptor) rozpoznający antygen CD19. Białko to występuje na powierzchni wszystkich limfocytów B do chwili ich przekształcenia w komórki plazmocytowe. CD19 stanowi biomarker limfocytów B.
Wyhodowano różne generacje komórek CAR-T, w zależności od składu domeny wewnątrzkomórkowej. (Wang V. et.all Cancers 2023, 15(4), 1003)
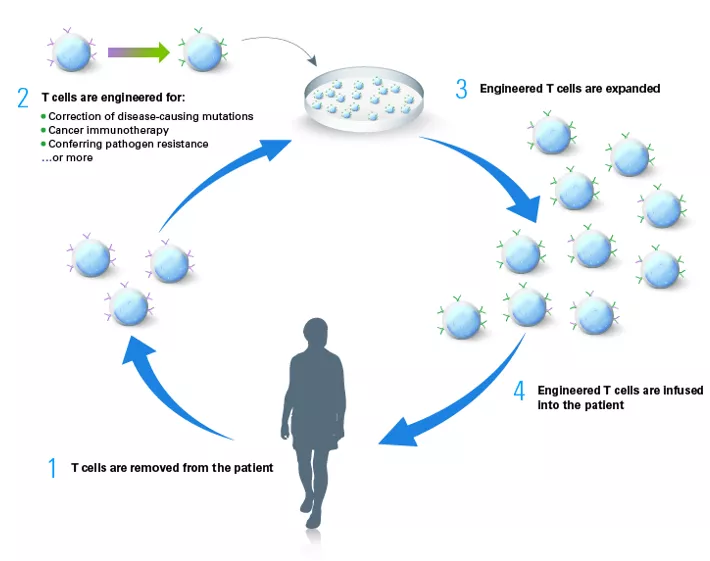
Fig.9 Protokół metod terapii opartych na wykorzystaniu limfocytów T prowadzących ekspresję wprowadzonego genu [źródło takarabio .com]
Postępy badań terapii genowej i poszukiwanie nowych celów zastosowania terapii genowej ? Jakie projekty w Polsce?
Badania kliniczne polegające wprowadzeniu terapeutycznych genów z udziałem komórek CAR-T przyspieszyły w ciągu ostatnich dwóch dekad. Badania te, zebrane na stronie Clinicaltrial. gov do 2022 r., pokazują że prym w podjętych próbach terapii genowej wiodą Stany Zjednoczone (n = 377) następnie Chiny (n = 636), podczas gdy Europa pozostaje daleko w tyle (n = 58). Wg pracy zespołu Wanga (Wang V. et.all Cancers 2023, 15(4), 1003), powodem są słabo rozwinięta współpraca akademicko-przemysłowa oraz różnice regulacyjne i finansowe. Naukowcy konkludują, że rozwiązanie tych problemów przyspieszyłoby opracowywanie terapeutyków tego typu.
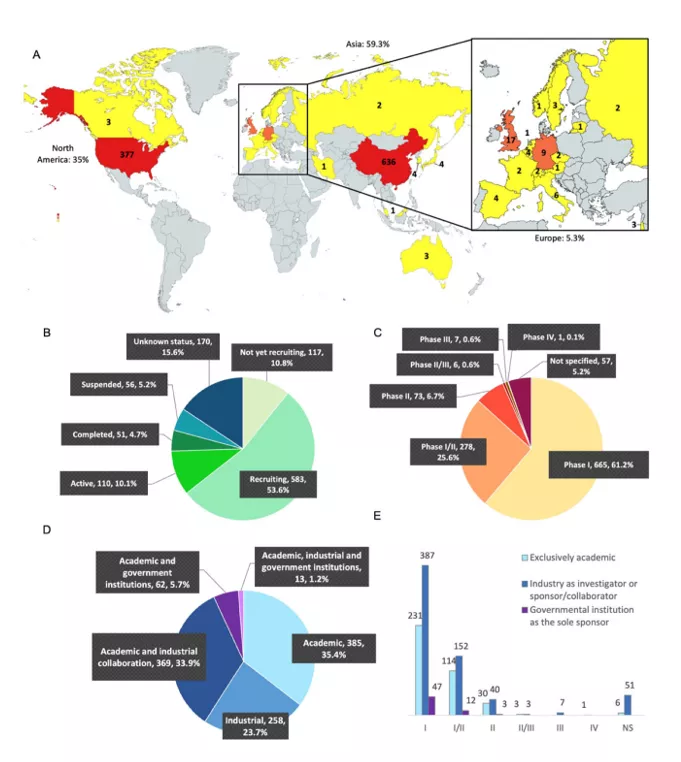
Fig.10 Prowadzone badania kliniczne nad komórkami CAR-T na świecie w 2022 r.
(A) Rozkład geograficzny: Stany Zjednoczone i Chiny dominują pod względem liczby badań, z odpowiednio 377 (34,7%) i 636 (58,5%) badaniami. Ameryka Północna jest również reprezentowana przez Kanadę (3 badania). Poza Chinami, w krajach azjatyckich przeprowadzono 9 badań (0,8%), w tym w Japonii (4), Korei Południowej (4), Malezji (1) i Iranie (1). W Europie przeprowadzono 58 badań (5,3%): Wielka Brytania (17), Niemcy (9), Włochy (6), Belgia (4), Hiszpania (4), Szwecja (3), Izrael (3), Szwajcaria (2), Czechy (2), Rosja (2), Francja (2), Litwa (1), Holandia (1), Austria (1) i Finlandia (1). Mapchart. net. (B) Rozkład statusu: 117 badań nie rozpoczęło rekrutacji (10,8%), 583 obecnie rekrutuje pacjentów (53,6%), 110 jest aktywnych (10,1%), 51 zostało zakończonych (4,7%), 56 zostało przerwanych (5,2%), a 170 ma nieznany status (15,6%). (C) Fazy badań: 665 badań znajduje się w fazie I (61,2%), 278 w fazie I/II (25,6%), 73 w fazie II (6,7%), 6 w fazie II/III (0,6%) i 7 w fazie III (0,6%). Jedno badanie znajduje się w fazie IV (0,1%), a w 57 badaniach nie podano informacji (5,2%). NS = nie określono. (D) Rozkład badań klinicznych według badaczy i współpracowników: spośród 1087 badań klinicznych 385 zostało wymienionych tylko z instytucją akademicką (35,4%), 258 zostało przeprowadzonych tylko przez przemysł farmaceutyczny (23,7%), 369 zostało przeprowadzonych przez ośrodek akademicki we współpracy z firmą przemysłową (33,9%), 62 zostały przeprowadzone przez ośrodek akademicki we współpracy z instytucją rządową, taką jak NIH (5,7%), i wreszcie 13 badań zostało przeprowadzonych we współpracy między tymi trzema podmiotami (1,2%). (E) Rozkład badań klinicznych według badaczy i współpracowników: liczba akademickich badań klinicznych lub we współpracy z przemysłem lub we współpracy z instytucją rządową według faz. Badania prowadzone przez trzy podmioty w tym samym czasie zostały dodane do grupy współpracy przemysłowej. [Wang V. et.all Cancers 2023, 15(4), 1003]
TakaraBio, kontrahent Biokomu także bierze udział w opracowywaniu terapii genowej związanych ze zmodyfikowanymi limfocytami T.
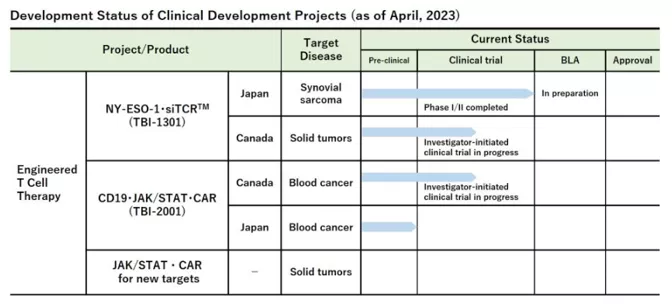
Fig.11 Lista badań klinicznych, w których bierze udział korporacja Takara Bio INC. [źródło takara-bio .com]
Warto wspomnieć w tym miejscu, że Polska ABM (Agencja Badań Medycznych) ogłosiła konkurs w 2020 roku na dofinansowanie projektu badawczo-rozwojowego, którego efektem końcowym będzie prowadzenie badań klinicznych z wykorzystaniem technologii CAR/CAR-T opracowanej przez polskie konsorcjum naukowe. Kwota dofinansowania wynosi 100 mln PLN. Wnioski zbierano do września 2020 roku. Konkurs nosił tytuł "Opracowanie polskiej terapii adoptywnej (CAR/CAR-T) z wykorzystaniem komórek immunokompetentnych modyfikowanych genetycznie". Wygrało go konsorcjum Polish Chimeric Antigen Receptor T-cell Network, (Car-NET) składające się z:
- Warszawskiego Uniwersytetu Medycznego (Lider),
- Narodowego Instytutu Onkologii im. Marii Skłodowskiej-Curie – Państwowy Instytut Badawczy,
- Uniwersyteckiego Centrum Klinicznego Warszawskiego Uniwersytetu Medycznego,
- Instytutu Hematologii i Transfuzjologii,
- Szpitala Klinicznego Przemienienia Pańskiego
- Uniwersytetu Medycznego im. Karola Marcinkowskiego w Poznaniu,
- Szpitala Uniwersyteckiego nr 1 im. dr. A. Jurasza w Bydgoszczy,
- Uniwersytetu Medycznego im. Karola Marcinkowskiego w Poznaniu,
- Pomorskiego Uniwersytetu Medycznego w Szczecinie
- Uniwersytetu Medycznego w Łodzi.
Celem projektu jest opracowanie od zera polskiego leku CAR-T o podobnej skuteczności do obecnie istniejących terapii złośliwych chłoniaków oraz ostrych białaczek z opornością na chemioterapię (R/R) w konkurencyjnej do istniejących cenie. Proces wytwarzania komórek CAR T będzie miał miejsce w Polsce w dedykowanym do tego laboratorium o standardzie GMP (Good Manufacturing Practice), Powstanie takiej placówki będzie możliwe również dzięki dotacji ABM. [pnitt.wum. edu.pl]
Założeniem terapii genowej opracowywanej w Polsce ma być optymalizacja jakości terapeutyku poprzez pobieranie limfocytów, które miały zmniejszoną ekspozycję na intensywną chemioterapię.
Ma być to przeprowadzone w czasie badania pilotażowego (CAR-NET-1). Limfocyty będą pobierane po niepowodzeniu pierwszej linii leczenia B-NHL i ALL, a po modyfikacji podane ponownie chorym, którzy nie uzyskają całkowitej remisji po zastosowaniu drugiej linii leczenia (2022-2023). Ale to nie jedyne modyfikacje wprowadzone przez Polaków z CAR-NET. Do pozostałych należą:
- wykorzystanie nanoprzeciwciał (VHH), mających zwiększyć efektywność i swoistość transdukcji. Powinno to bezpośrednio przełożyć się na skuteczność wprowadzania genów metodą wirusową, a co za tym idzie, ilości wytworzonego preparatu. Badania I/II fazy (CAR-NET-2) (2024-2025) ze strategią „wyprzedzającego” pobierania limfocytów, ustaleniem maksymalnej tolerowanej dawki oraz bezpieczeństwa i skuteczności terapii u chorych na agresywne B-NHL.
- stworzenie limfocytów CART o swoistości anty-CD19/CD22 z mechanizmem farmakologicznego „wyłączania” i „włączania” powiązanych z antygenem CD22. Podczas pierwszego podania będzie aktywna jedynie kompetencja anty-CD19. W przypadku oporności/wznowy lub nadmiernej toksyczności nastąpi jej wyciszenie i włączenie kompetencji anty-CD22. Ma to zwiększyć skuteczność i bezpieczeństwo terapii w porównaniu do tych istniejących na rynku. Badania I fazy (CAR-NET-3) z ustaleniem maksymalnej tolerowanej dawki przypadną na lata 2024-2025.
Ponadto badaniom klinicznym będą towarzyszyły badania ekspansji limfocytów CAR-T in vivo, mechanizmów żywotności oraz mechanizmów oporności. Równolegle trwać będą badania przedkliniczne na liniach komórkowych i w modelach zwierzęcych w alternatywnych zastosowaniach, jak nowotwory lite (m. in. glejaka wielopostaciowego) oraz u chorych na nefropatię IgA (choroba autoimmunologiczna). [pnitt.wum. edu.pl]
Wybrane wyzwania napotkane podczas przygotowania terapii z wykorzystaniem limfocytów T
Rodzaje terapii komórkowej z wykorzystaniem limfocytów T
Jak pokazały przytoczone powyżej wyniki analiz, podanie zmodyfikowanych limfocytów pacjentom może mieć/ma działanie leczące nowotwory. Warto wspomnieć, że poza wspomnianymi terapiami z użyciem CAR-T, czyli limfocytów T (lub innych komórek PBMC) eksprymujących chimeryczne receptory antygenów, można wyróżnić jeszcze przynajmniej dwie inne:
- TIL od tumor-infiltrating lymphocytes, czyli polegającą na pobraniu, weryfikacji, a następnie namnożeniu limfocytów mających zdolność do penetracji guza i jego transformacji oraz
- TCR T cells czyli terapii najczęściej limfocytami T, eksprymującymi odpowiednie receprotory TCR (T-cell receptor) rozpoznające zmienione nowotworowo komórki, a następnie wywołujące w nich zmiany np. apoptozę.
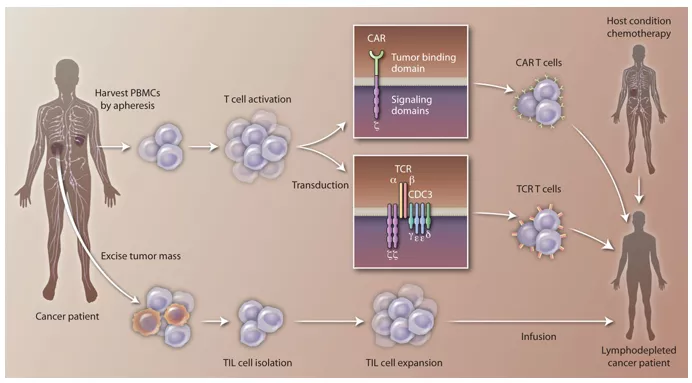
Fig.12 Główne protokoły terapii komórkowej: CAR-T (chimeric antigen receptor therapy), TIL (tumor-infiltrating lymphocytes therapy) oraz TCR-T (T-cell receptor therapy). [źródło: June CH et al. Science Translational Medicine 2015: Vol. 7]
Jednak pozyskanie materiału - "żywego leku" niezależnie od podejścia terapii komórkowej, niesie za sobą wiele wyzwań. Zazwyczaj limfocyty uzyskuje się od leczonego pacjenta (lub w fazie badań przedklinicznych myszy), modyfikuje się je odpowiednio i podaje zwrotnie odpowiednio ukompetentnione (terapie autologiczne, np. CAR-T). Innym sposobem jest podanie stworzonych limfocytów od innego dawcy- rozwiązanie to jest jednak kłopotliwe ze względu na antygeny głównego układu zgodności tkankowej - MHC (major histocompatibility complex) (terapie allogeniczne, np. TIL). W obu przypadkach wyzwanie stanowi liczba komórek.
Aby przeprowadzić skuteczną terapię trzeba podawać miliony komórek w przeliczeniu na kg masy ciała. To niesie ze sobą pewien kłopot ze względu na potencjał proliferacyjny tych limfocytów. Ponadto, jak się okazało nie tylko ilość ale i "jakość"/"kompetencja" ma znaczenie. Badania doktorów Christophera Klebanoff , Nicholasa Restifo, pokazują, że charakter komórek CD 8+ jest istotny [J Clin Invest . 2016 Jan;126(1):318-34]. Zdecydowanie większy potencjał terapeutyczny ma podawanie komórek T CD8+ tzw. naiwnych o fenotypie CCR7+/CD45RA+, czyli takich bez ukształtowanej pamięci. Co więcej, negatywny wpływ na liczbę tych cennych komórek ma interakcja z limfocytami T dojrzałymi.
Powstaje więc pytanie jak możemy zwiększyć liczbę komórek do pożądanej a jednocześnie zwiększyć frakcję naiwnych limfocytów cytotoksycznych?
Z pomocą może przyjść tzw. coat hodowlany – Retronektyna oraz medium do hodowania komórek LymphoOne firmy Takara Bio.
Retronektyna, czyli zrekombinowany fragment białka fibronektyny (rFN-CH-296) poprzez odziaływanie z receptorami VLA 4 i 5 zwiększa proliferację limfocytów (Fig 13, 14 i 15). Po stymulacji jedynie receptora CD3 wzrost proliferacji nie był tak znaczący jak w przypadku, gdy komórki stymulowane były przeciwciałem anty CD3 i Retronektyną. Co ważne, w przypadku hodowli w opisanych warunkach zmienia się także liczba komórek subpopulacji limfocytów T cytotoksycznych (Tc) tzw. naiwnych (Fig.14/15), czyli tych, które jak pokazują badania maja największy potencjał terapeutyczny.
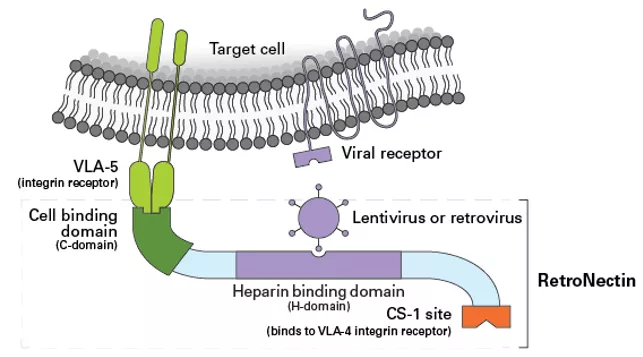
Fig.13 Struktura i funkcja Retronektyny, rekombinowego fragmentu fibronektyny. [źródło takarabio .com]
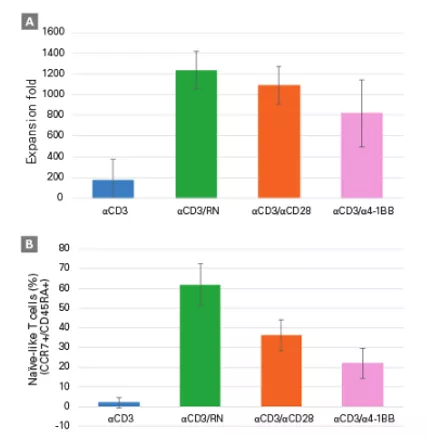
Fig.14 Hodowla limfocytów T na Retronektynie wpływa pozytywnie na ich liczbę i potencjał terapeutyczny
Limfocyty T stymulowane Retronektyną (RN) oraz przeciwciałem anty CD3 proliferowały lepiej niż traktowane jedynie przeciwciałem lub w kombinacji z anty CD28/1BB (A). Większa była także liczba komórek o fenotypie tzw. naiwnym (CCR7+/CD45RA+) (B) [źródło takarabio .com]
Potwierdzają to także badania Yu i współpracowników [Cancer Gene Therapy volume 15, pages508–516 (2008)]. Dokumentują oni, że hodowla prowadzona w odpowiedni sposób może wpłynąć na rodzaj uzyskanych limfocytów T. Aby pobudzić komórki do podziałów aktywowano je przeciwciałem anty CD3 oraz kostymulowano przeciwciałem anty CD28 lub hodowano na Retronektynie. Hodowla z użyciem tej ostatniej wpłynęła stymulująco na limfocyty T cytotoksyczne (CD8+) sprawiając, że ich udział w całej populacji się zwiększył porównując z dniem zero.
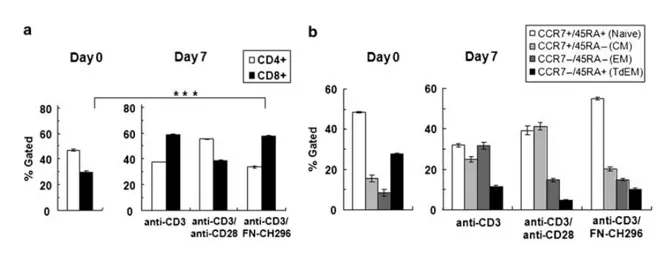
Fig.15 Kostymulacja anty-CD3/FN-CH296 (Retronektyna) wpływa na preferencyjną generację limfocytów CD8+ o fenotypie naiwnym.
W dniu 7, populacje transdukowane porównano z niestymulowanymi limfocytami krwi obwodowej pod kątem antygenów obecnych na ich powierzchni. Wyniki z komórek od jednego z trzech reprezentatywnych dawców. Eksperymenty przeprowadzono w trzech powtórzeniach; podano średnie ± s.d. . (a) Po bramkowaniu dla CD3+, komórki analizowano za pomocą cytometrii przepływowej pod kątem ekspresji CD4+ lub CD8+. (b) Komórki analizowano za pomocą cytometrii przepływowej pod kątem ekspresji CD45RA i ekspresji CCR7. [Yu SS et al.. Cancer Gene Therapy volume 15, pages 508–516 (2008)]
Produktem wspierającym hodowlę limfocytów jest także wspomniane już wcześniej medium do hodowli LymphoOne, dawniej GT-T551. Medium zapewnia znakomitą przeżywalność komórek i propagację podziałów. Wykazuje dużo lepsze rezultaty niż produkty znanych konkurentów, również w pod względem zwiększania udziału frakcji naiwnych limfocytów Tc (Fig.17)
Co ważne, medium można stosować także bez dodatku surowicy ludzkiej (bez ksenobiotyków), to ma duże znaczenie w dalszych etapach prac, kiedy konieczne jest stosowanie odczynników pozbawionych dodatków odzwierzęcych (xenofree), a za to o ustandaryzowanym i powtarzalnym składzie. Pożywka zawiera dodatki ludzkiej albuminy, ludzką insulinę, L-glutaminę i antybiotyk streptomycyny. Korzystając z tego medium nie musimy się martwić czy surowica, z której korzystamy w hodowli spełnia niezbędne certyfikacje i jest wolna od toksyn, prionów i innych domieszek. Hodowla staje się także tańsza w utrzymaniu.
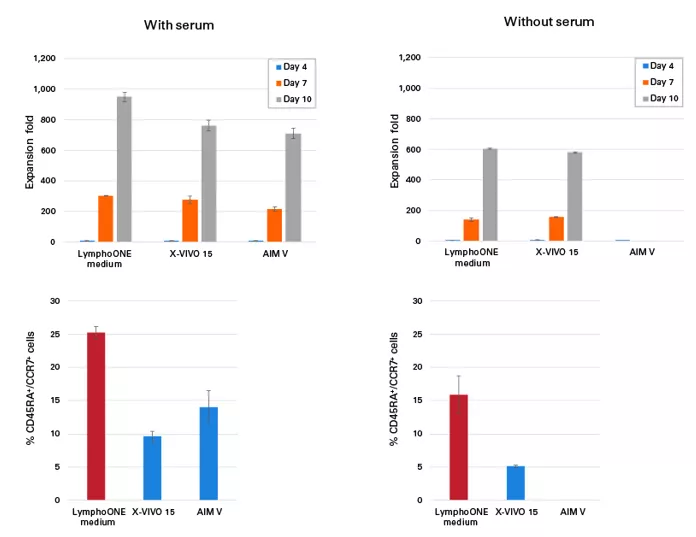
Fig.17 Propagacja wzrostu limfocytów T hodowanych w różnych dostępnych komercyjnie mediach z surowicą i bez.
LymphoOne (dawniej GT-T551) pozwala na otrzymanie większej populacji komórek niezależnie od obecności surowicy. ) Pozwala także zwiększenie frakcji komórek o fenotypie naiwnym. [źródło takarabio .com]
Jak zwiększyć skuteczność terapii genowych związanych z limfocytami T?
Jak już zostało to pokazane, ważnym czynnikiem jest fenotyp komórek CD3+/CD8+/CCR7+/45RA+.
Badania pokazały także, że użycie podczas hodowli coatu – Retronektyny istotnie wpływa na subpopulacje komórek w hodowli, znacznie zwiększając uzysk komórek limfocytów T cytotoksycznych naiwnych o fenotypie CCR7+/45RA+, zmniejszając udział tych związanych z pamięcią immunologiczną CCR7+/45RA- . Jak wynika z wcześniej cytowanego artykułu, im więcej limfocytów o takim fenotypie tym większa szansa na uzyskanie pozytywnych wyników terapeutycznych. Podanie preparatów komórkowych z większą liczbą komórek naiwnych wywiera lepszy efekt na organizm biorcy. Komórki hodowane na Retronektynie mają większy potencjał do infiltracji narządów biorcy (tzw. engraftment). Wykazano, że znajdowały się one częściej w szpiku kostnym i grasicy biorcy niż te pochodzące jedynie z hodowli stymulowanej anty CD3. [Yu SS et al. Cancer Gene Therapy volume 15, pages508–516 (2008)] Ta zdolność także jest bardzo istotna podczas terapii nowotworów.
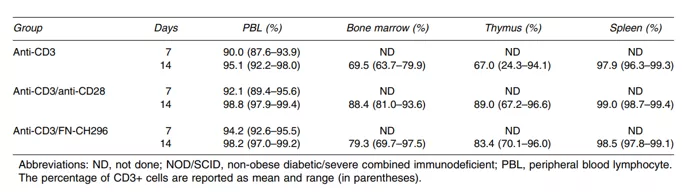
Fig.18 Obecność zmodyfikowanych limfocytów T (in vivo, w myszach NOD/SCID)
Limfocyty T stymulowane anty CD3 i hodowane na Retronektynie są częściej znajdywane w narządach obwodowych tj. w szpiku i grasicy. [Yu SS et al. Cancer Gene Therapy volume 15, pages508–516 (2008)]
Warto wspomnieć dlaczego terapie TCAR koncentrują się na tym fenotypie limfocytów. Komórki te mają zdolność do wywoływania apoptozy po rozpoznaniu komórki docelowej. Lecz to nie wszystko. Mają potencjał do generacji wieloczynnikowej odpowiedzi ze strony układu immunologicznego poprzez ekspresję np. cytokin IFN-gamma, TNF-alfa.
Jak wskazały badania Hosci i współpracowników, hodowla komórek kostymulowanych przez receptory VLA 4 i 5 (receptory dla Retronektyny) pozytywnie wpływa na utrzymanie ich multifunkcjonalności. Więcej komórek eksprymowało IFN gamma, TNF alfa oraz prezentowało na swojej powierzchni marker wyrzutu granul cytotoksycznych - CD107a (Fig19). Co więcej, wykazywały one większą cytotoksyczność w stosunku do allogenicznych i docelowych (targetowych) antygenów, a więc były skuteczniejsze (Fig.18), co wpływa na skuteczność terapii. [Hosoi H. et al. Eur J Immunol. 2014; Vol:44 (6):1747-1758]
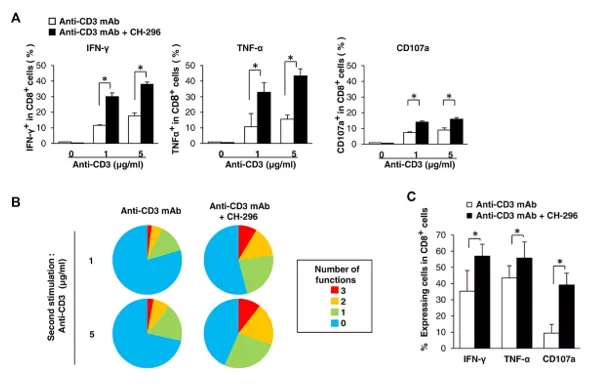
Fig19. Stymulacja receptorów VLA 4 i 5 (receptorów również dla retronektyny) poprzez czynnik CH-296 wpływa pozytywnie na multifunkcjonalność limfocytów T CD8+ i formowanie pamięci komórkowej
Ludzkie komórki PBMC (A, B i E) lub mysie komórki śledziony pochodzące z DUC18-Tg (C) były stymulowane w różnych kombinacjach CH-296 w połączeniu z mAb anty-CD3. (A) Siedem dni po stymulacji, ludzkie PBMC komórki były ponownie stymulowane wskazanymi stężeniami mAb anty-CD3, a następnie badane pod kątem produkcji funkcjonalnych markerów limfocytów T CD8+ (IFN-γ, TNF-α i CD107a) za pomocą cytometrii przepływowej. (B) Dane dotyczące wielofunkcyjności z trzech niezależnych próbek komórek PBMC podsumowano na wykresie kołowym, w którym każdy kolor reprezentuje procent komórek T CD8+ wyrażających wszystkie trzy funkcje (IFN-γ+TNF-α+CD107a+) (3), dowolne dwie funkcje (IFN-γ+TNF-α+CD107a-, IFN-γ+TNF-α-CD107a+ lub IFN-γ-TNF-α+CD107a+) (2), dowolną pojedynczą funkcję (IFN-γ+TNF-α-CD107a-, IFN-γ-TNF-α+CD107a- lub IFN-γ-TNF-α-CD107a+) (1) lub brak funkcji (0). (C) Po 6 dniach hodowli in vitro, mysie komórki śledziony (DUC18-Tg) ponownie stymulowano komórkami P1.HTR, a następnie oznaczano częstość występowania limfocytów T CD8+ wykazujących produkcję cytokin i mobilizację CD107a za pomocą cytometrii przepływowej. Dane w A, C, E przedstawiają średnie SD trzech próbek. (A-C) Wyniki są reprezentatywne dla trzech niezależnych eksperymentów. [źródło: Hosoi H. et al. Eur J Immunol. 2014; Vol:44 (6):1747-1758]
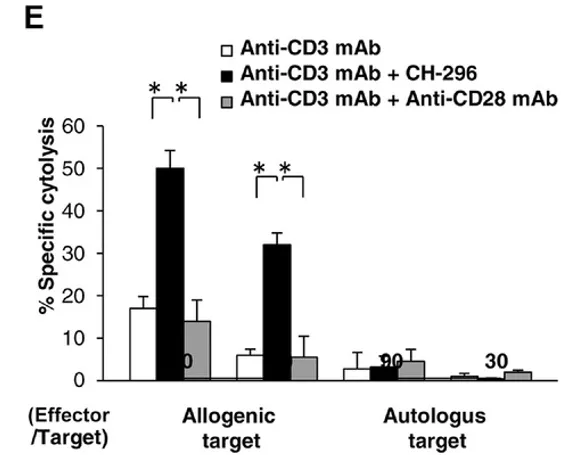
Fig.20 Specyficzność cytotoksyczności limfocytów T CD8+ zależnie od pochodzenia antygenu oraz warunków hodowli.
Limfocyty T stymulowane również poprzez receptory VLA 4 i 5 wykazują bardziej celowaną specyficzność. (E) Po 7 dniach kostymulacji anty-CD3 z CH-296 lub anty-CD28, ludzkie limfocyty zmieszano z allogenicznymi lub autologicznymi komórkami docelowymi PHA w stosunku 90 /30. Cytotoksyczność oceniano za pomocą testu uwalniania kalceiny. Wyniki są reprezentatywne dla dwóch niezależnych eksperymentów. Różnice między grupami zbadano pod kątem istotności statystycznej za pomocą testu t-Studenta. *p < 0.05.
[źródło: Hosoi H. et al. Eur J Immunol. 2014; Vol:44 (6):1747-1758]
W przypadku terapii TCAR, Retronektyna może więc mieć podwójne zastosowanie - do stymulacji i polepszenia jakości preparatu komórkowego, jak i do transdukcji lentiwirusowej tych komórek. Pierwotnym przeznaczeniem Retronektyny była transdukcja wektorami wirusowymi (Fig13). Dzięki oddziaływaniu z receptorami na powierzchni komórek linii mieloidalnej (VLA 4 i 5), filamenty coatu hodowlanego zapewniają fizyczny kontakt cząstek lentiwirusowych związanych przez specjalną domenę z błoną komórkową limfocytów. Zapewnia to znacznie lepsze efektywności transdukcji komórek niż polibren w przypadku komórek nie adherentnych.
Innym wyzwaniem terapii komórkowej jest konieczność zapewnienia wysokich standardów. Produkty powinny być w standardzie GMP wolne od składników odzwierzęcych o ustandaryzowanym składzie. Takie odczynniki można znaleźć w naszej ofercie (Fig.21).
Wspomniana retronektyna była używana w ponad 68 protokołach badań klinicznych w 44 instytucjach na całym świecie.
Przykłady publikacji z prowadzonych terapii:
- Metastatic Synovial Cell Sarcoma and Melanoma: Transduction of patient-derived lymphocytes with TCR/CAR genes that recognize cancer antigens (e.g., MART-1, gp100, or NY-ESO-1) for therapy (Robbins et al. 2011, J Clin Oncol 29:917-92).
- Multiple Myeloma: Anti-BCMA CAR T cells (Ali, S. A. et al. 2016 Blood 128, 1688–1700).
- B-cell malignancies (Follicular lymphoma, CLL): Transduction of patient derived T-cells with anti-CD19-CAR (Kochenderfer et al., 2012, Blood 119(12):2709-20).
- B cell acute lymphoblastic leukemia (B-ALL): Five relapsed B-ALL subjects have been treated with autologous T cells expressing a CD19-specific CD28/CD3ζ second-generation dual-signaling chimeric antigen receptor (CAR) termed 19-28z (Brentjens RJ et al., 2013, Sci Transl Med. 5(177):177ra38)

Fig.21 Dedykowane produkty w standardzie GMP
Więcej o "Adoptive T-cell therapy - Solutions for T-cell engineering and expansion (TakaraBio)" w prezentacji.
Materiały do pobrania: