Separacja komórek technologią EasySep™
01 Sierpnia 2023 (Ostatnia aktualizacja 17.10.2024)
Współczesne badania naukowe wymagają szybkich i efektywnych rozwiązań. Aby sprostać tym oczekiwaniom naukowcy ze STEMCELL opracowali najwydajniejszy sposób izolowania komórek w technologii EasySep™. Łączy ona specyficzność przeciwciał monoklonalnych z prostotą bezkolumnowego systemu magnetycznego, w celu szybkiej i łatwej izolacji wysoce oczyszczonych komórek, które są gotowe do dalszych zastosowań. Ta wszechstronna immunomagnetyczna technologia separacji komórek umożliwia selekcję pozytywną, selekcję negatywną.
EasySep™ to powszechnie stosowana metoda izolacji.
Od momentu wprowadzenia na rynek w 2002 r., systemy EasySep™ są używane przez naukowców z całego świata, a lista publikacji przekracza 7000.
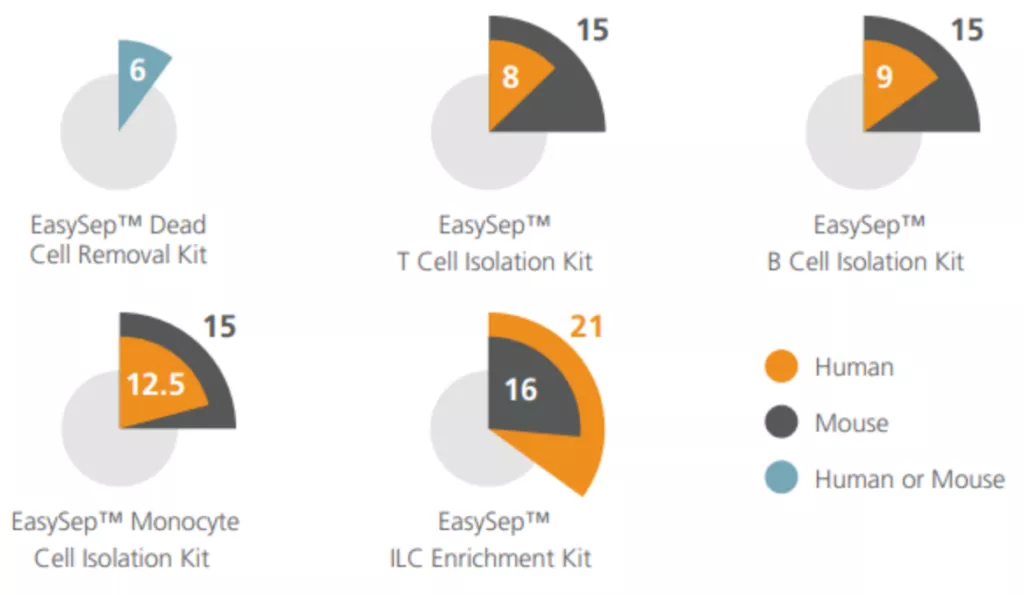
Szybkość izolacji systemami EasySep™
Wykorzystanie silnych magnesów zamkniętych rodziny EasySep™, oraz nanocząsteczek magnetycznych RapidSpheres™ gwarantuje ultra-szybkie, nawet kilkuminutowe protokoły izolacji. Systemy EasySep™ są w stanie izolować niektóre populacje komórek w zaledwie 8 minut. Typowe populacje ludzkich komórek odpornościowych można wyizolować w zaledwie 8 minut, a populacje typowych mysich komórek odpornościowych w ledwie 15 minut. Średni czas protokołu izolacji komórek dla wszystkich zestawów EasySep™ nowej generacji, w tym dla bardziej złożonych typów komórek, które wymagają sekwencyjnej separacji (np. limfocyty T regulatorowe), wynosi tylko 20 minut. EasySep™ to gwarancja najprostszych i najszybszych protokołów izolacyjnych.
Systemy izolacji EasySep™ akceptują różne źródła pochodzenia próbek
W zależności od typu zestawu i rodzaju komórek, izolację można przeprowadzić z różnych próbek:
- pełna krew
- kożuszek leukocytarno-płytkowy - składnik krwi powstały z odwirowania krwi pełnej, zawierający znaczną część leukocytów i płytek krwi.
- szpik kostny
- krew pępowinowa
- Leukopak (wzbogacony produkt aferezy pobrany za pomocą leukaferezy, czynności polegającej na ekstrakcji białych krwinek (WBC) z krwi obwodowej)
- PBMC - jednojądrzaste komórki krwi obwodowej - izolowane ze świeżo pobranej heparynizowanej krwi przez wirowanie w gradiencie gęstości przy użyciu preparatu Lymphoprep. Są to limfocyty T; cytotoksyczne (Tc), pomocnicze (Th), regulatorowe (Treg), komórki NK, limfocyty B
- Izolat komory leukoredukcyjna - oparte na filtrach separatory komórkowe umożliwiające otrzymanie ubogoleukocytarnych składników krwi
- splenocyty
- węzły chłonne
z różnych gatunków (np. człowieka, myszy, naczelnych innych niż człowiek, szczur, królik, krowa i świnia).
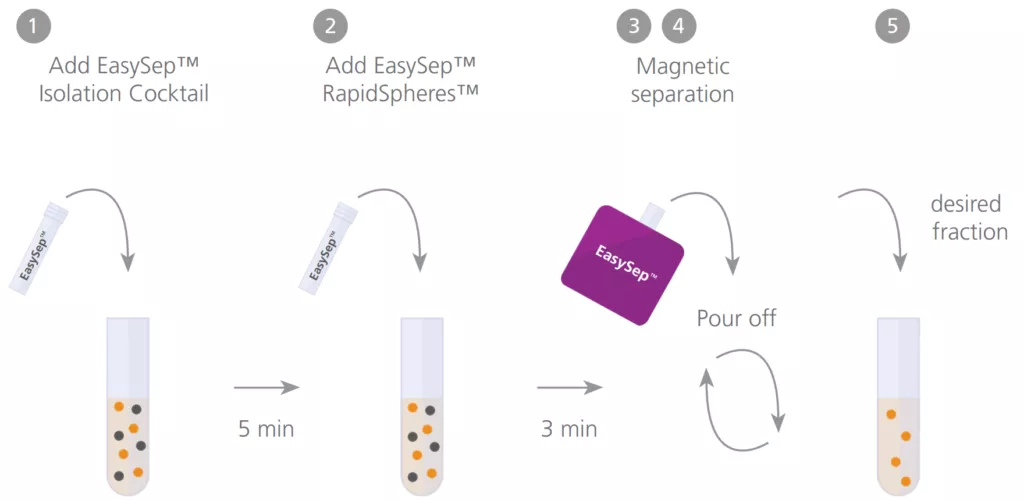
EasySep™ selekcja pozytywna vs. selekcja negatywna.
To, czy zastosować metodę selekcji pozytywnej, czy selekcji negatywnej, jest jednym z najczęściej zadawanych pytań dotyczących separacji immunomagnetycznej komórek.
Metoda immunomagnetycznego rozdzielania komórek w następstwie selekcji pozytywnej wymaga bezpośredniego znakowania pożądanych komórek do selekcji przeciwciałem lub ligandem, które rozpoznają określone białko powierzchniowe komórki. Przeciwciało lub ligand są połączone z nanocząsteczkami magnetycznymi, co umożliwia zatrzymanie znakowanych komórek w końcowej wyizolowanej frakcji po inkubacji próbki w polu magnetycznym.
Podstawowe cechy metody pozytywnej selekcji magnetycznej:
- wyizolowane komórki są wysoce oczyszczone
- izolowane komórki są zwykle związane przeciwciałami i cząstkami magnetycznymi
- koktajl przeciwciał rozpoznaje zestaw unikatowych markerów powierzchniowych na komórkach docelowych
- można wyizolować dodatkowe populacje komórek z frakcji ujemnej
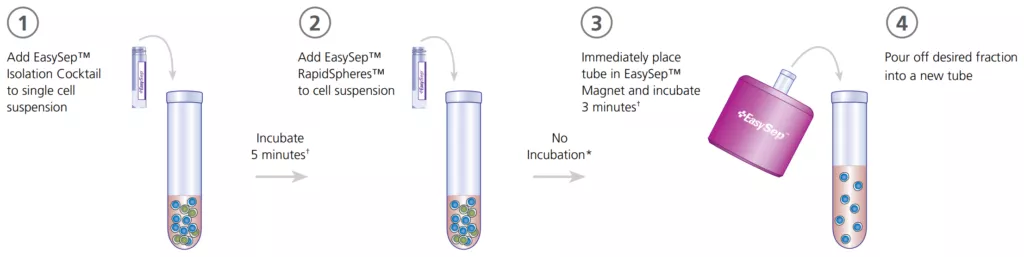
Separacja komórek w wyniku selekcji negatywnej, również wykorzystuje przeciwciała lub ligandy skierowane przeciwko określonym białkom powierzchniowym komórek ale tym razem w celu ich usunięcia. Przeciwciała lub ligandy są połączone z nanocząstkami magnetycznymi, co pozwala na usunięcie znakowanych, niepożądanych komórek z końcowej wyizolowanej frakcji poprzez inkubację próbki w polu magnetycznym. Ponieważ pożądane komórki nie są specyficznie ukierunkowane przez przeciwciała lub ligandy, pozostają niezwiązane cząstkami.
Typowe cechy negatywnych metod selekcji magnetycznej:
- izolowane komórki nie są związane cząstkami magnetycznymi
- protokoły są szybsze i łatwiejsze przy minimalnej manipulacji próbkami
- koktajl przeciwciał celuje we wszystkie niepożądane komórki z wyjątkiem pożądanych komórek
EasySep™ kombinacja selekcji pozytywnej i negatywna w przypadku izolacji szczególnych populacji komórek
Niektóre typy komórek mogą wymagać kombinacji negatywnej i pozytywnej selekcji w celu pomyślnego ich oczyszczenia. Na przykład izolacja limfocytów regulatorowych (Treg) CD4+ CD127low CD25+ jest wyzwaniem ze względu na konieczność selekcji na podstawie trzech różnych markerów powierzchniowych. Umożliwia to technologia EasySep™ łącząc strategie negatywnej i pozytywnej selekcji.
Obrazuje to poniższy schemat.
Kompatybilność EasySep™ z FACS.
FACS Pre-enrichment (Selekcja negatywna do szybkiego wstępnego wzbogacenia komórek docelowych przed FACS).
Izolowanie rzadkich typów komórek za pomocą FACS (fluorescence-activated cell sorting / sortowanie komórek aktywowane fluorescencją) może wiązać się z długimi czasami sortowania. Naukowcy mogą znacznie skrócić wymagany czas sortowania komórek, stosując immunomagnetyczną separację komórek w celu wstępnego wzbogacenia komórek docelowych. W takim przypadku pożądane są szybkie protokoły i wysoki odzysk, aby zaoszczędzić czas i zmaksymalizować wydajność komórek docelowych wynikającą z procedury sortowania przepływowego. Selekcja negatywna jest zazwyczaj idealnym podejściem, ponieważ jest szybka, zapewnia bardzo wysoki poziom odzysku i nie znakuje komórek będących przedmiotem zainteresowania. Pozwala to naukowcom na wykorzystanie dowolnych przeciwciał znakowanych fluoroforem przeciwko specyficznym markerom powierzchniowym komórek, które będą izolowane w sorterze FACS.
Wstępne wzbogacenie można przeprowadzić przed FACS dla szerokiej gamy określonych populacji komórek, w tym komórek specyficznych dla antygenu, populacji limfocytów Th, limfocytów B i wrodzonych komórek limfoidalnych (ILC) etc.

| Rozpoczynając od świeżej próbki leukaferezy, wyizolowano ludzkie nieswoiste komórki limfoidalne (ILC) metodą sortowania komórek aktywowanych fluorescencją (FACS) równolegle z próbki niewzbogaconej lub wzbogaconej w EasySep™. (A) |
| W niewzbogaconej próbce częstotliwość ILC oceniano za pomocą cytometrii przepływowej na początku i po jednej rundzie FACS. (B) |
| W próbce wzbogaconej w EasySep™ częstotliwość ILC oceniano natychmiast po wzbogaceniu w EasySep™ i ponownie po jednej rundzie FACS. (C) Odpowiednie czystości i czasy FACS na każdym etapie. |
EasySep™ - wysoka czystość i odzysk izolowanych komórek
Protokoły separacji komórek EasySep™ są nieustannie optymalizowane, dzięki czemu można osiągnąć najwyższą czystość i odzysk izolowanych komórek.
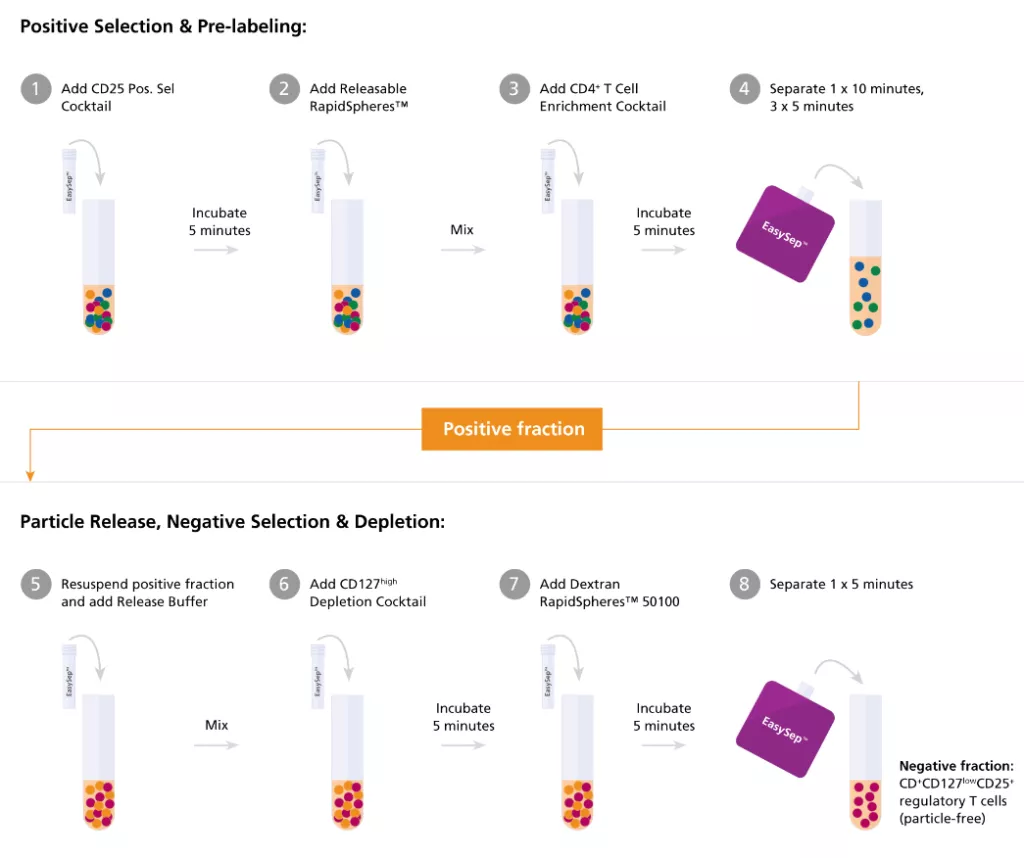
 | Wykres 1. EasySep™ zapewnia co najmniej równoważną lub lepszą czystość i odzysk ludzkich limfocytów T w porównaniu z technologią kolumnową. Komórki T izolowano przez selekcję negatywną (Neg Sel) lub selekcję pozytywną (Pos Sel) przy użyciu systemów EasySep™ lub dostępnej w handlu technologii opartej na kolumnach. Izolacja EasySep™ dała porównywalną lub lepszą czystość (A) i odzysk (B) z dostępnym na rynku systemem. Dane przedstawiono jako średnią ± SEM; n = 3. |
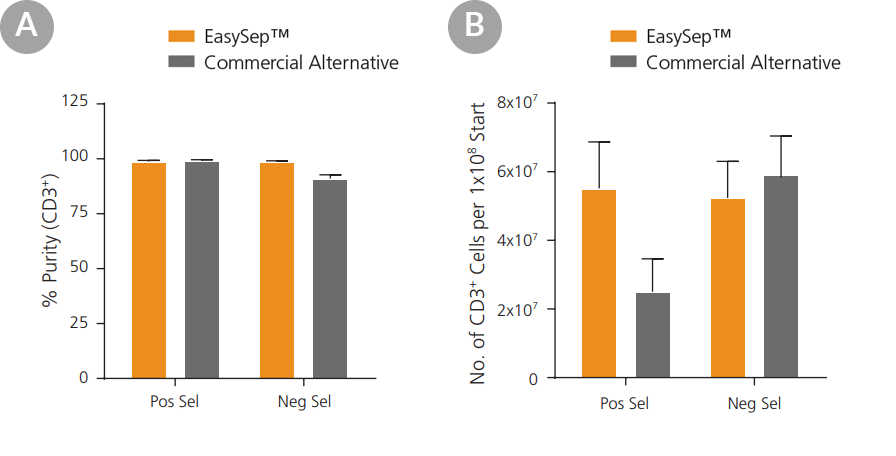
 | Wykres 2. EasySep™ zapewnia co najmniej równoważną lub lepszą czystość i odzysk mysich komórek CD11b+ w porównaniu z technologią kolumnową. Komórki CD11b+ wyizolowano ze śledziony myszy przez pozytywną selekcję przy użyciu EasySep™ lub dostępnego w handlu zestawu opartego na kolumnach. Postępowano zgodnie z protokołem alternatywnej wersji handlowej, stosując ich standardowy protokół lub ich opcjonalny protokół „wysokiej czystości”, który zalecał dodatkową kolumnę. Izolacja EasySep™ dała porównywalną lub lepszą (A) czystość i (B) odzysk. Dane przedstawiono jako średnią ± SEM; n = 4 - 6. |
Magnesy EasySep™
STEMCELL oferuje wiele rodzajów wysokowydajnych magnesów do separacji immunomagnetycznej, Obsługują one zarówno probówki polistyrenowe (5, 14, 50 ml), płytki 96-dołkowe, oraz butelki hodowlane T-25. Daje to niezrównaną wolność w doborze naczynia hodowlanego w którym dokonywana będzie izolacja.

| Nr katalogowy | Nazwa | Obsługiwane naczynie / maksymalna ilość komórek |
| 18000 | EasySep™ Magnet | 5 ml (12 x 75 mm) probówki PS2,5 x 108 komórek |
| 18001 | “The Big Easy” EasySep™ Magnet | 14 ml (17 x 95 mm) probówki PS1 x 109 komórek |
| 18002 | Easy 50 EasySep™ Magnet | 50 ml (30 x 115 mm) probówki PS4 x 109 komórek |
| 100-0821 | Easy 250 EasySep™ Magnet | 225 ml, standardowa butelka hodowlana T-25 1.25 x 1010 komórek |
| 18103 | EasyEights™ EasySep™ Magnet | 5 ml (12 x 75 mm) probówki PS + 14 ml (17 x 95 mm) probówki PS0,1 x 108 do 8,5 x 108 komórek |
| 18102 | EasyPlate™ EasySep™ Magnet | Standardowa płytka 96-dołkowa2 x 107 komórek / dołek |