POROZMAWIAJMY O EDYCJI!
05 Lutego 2025
Czym jest edycja genów?
Do czego jest nam potrzebna?
I dlaczego może zrewolucjonizować nasze życie?
Najprościej rzecz ujmując, edycja genów to proces modyfikacji materiału genetycznego organizmów w celu poprawy ich cech lub leczenia chorób genetycznych. Narzędzia edycji genów pozwalają na precyzyjne wprowadzanie zmian w sekwencji DNA, co otwiera nowe możliwości w medycynie, rolnictwie i badaniach biologicznych.
Obecnie istnieje kilka metod edycji genomu, z których najpopularniejsze to:
- TALENs (Transcription Activator-Like Effector Nucleases) – technika wykorzystująca specjalne nukleazy sprzężone z białkami efektorowymi (TAL). Każda nukleaza TALEN składa się z dwóch części: domeny wiążącej DNA, oraz domeny nukleolitycznej. Ze względu na prostotę budowy elementów wiążących DNA możliwe jest szybkie i łatwe modyfikowanie tych niezwykle efektywnych enzymów. To z kolei przekłada się na większe spektrum zastosowania tej metody;
- ZFN (Zinc Finger Nucleases) – to starsza, ale nadal skuteczna metoda edycji genów. Technologia ta wykorzystuje sztucznie zaprojektowane białka „wyposażone” w motyw palca cynowego, które mogą precyzyjnie wiązać się z określonymi sekwencjami DNA. Każda nukleaza ZFN składa się z domeny wiążącej DNA z motywem palca cynkowego oraz domeny nacinającą DNA, posiadającej enzym restrykcyjny typu IIS, np. FokI
- CRISPR/Cas9 – technologia bazująca na dwóch kluczowych elementach: endonukleazie (najczęściej) Cas9, czyli enzymie tnącym DNA w określonym miejscu, oraz sprzężonej z nią cząsteczce sgRNA (single guide RNA), sekwencji RNA kierującej Cas9 do docelowego genu.
To właśnie metodzie CRISPR/Cas9 zostanie poświęcona pierwsza część spotkania, które odbędzie się 13.02.2025 roku w Centrum Futuri w Białymstoku.
Emmanuelle Charpentier i Jennifer A. Doudna zostały w 2020 roku uhonorowane Nagrodą Nobla w dziedzinie chemii za rozwój metody CRISPR/Cas9, nazywanej potocznie precyzyjnymi nożyczkami genetycznymi. Należy jednak pamiętać, że zainteresowanie wielu badaczy oraz jednostek naukowych na całym Świecie tym niezwykle precyzyjny narzędziem do edycji genów sięga późnych lat 80-tych XX wieku.
Jeśli chcesz dowiedzieć się więcej o historii badań nad metodą CRISPR/Cas to odwiedź naszą stronę internetową i zapoznaj się z materiałem - CRISPR/Cas9 – historia, zastosowania i nowe metody syntezy ssDNA.
Jak wspomniano, CRISPR/Cas jest potężnym narzędziem do edycji genomów. Ponadto, jest to metoda stosunkowo tania, wydajna i relatywnie prosta w wykonaniu. W eksperymentach mających na celu wyciszenie poszczególnych genów tzw. knock-out genów, do przeprowadzenia eksperymentu (w dużym uproszczeniu) konieczna jest znajomość docelowej sekwencji, odpowiednio zsyntetyzowany sgRNA oraz sprzężone z nim białko z rodziny Cas. Generowane w wyniku działania endonukleaz z rodziny Cas „rozcięcia” obu nici DNA są następnie naprawiane w wykorzystaniem mechanizmu łączenia niehomologicznych zakończeń (NHEJ, ang. non homologous end joining). Mechanizmy te generują liczne błędy w kodzie genetycznym, w wyniku których dochodzi do zmiany ramki odczytu lub mutacji, które wpływają na funkcjonalność genów lub eksprymowanych białek. Odmienne mechanizmy naprawy DNA wykorzystywane są w eksperymentach polegających na wprowadzaniu do sekwencji docelowych określonych polimorfizmów pojedynczych nukleotydów (SNP, ang. single nucleotide polymorphism), krótkich lub długich insercji. Knock-in genów, bo tak nazywane są te eksperymenty, poza sgRNA oraz dostępnością białka Cas wymaga obecności odpowiednio zsyntetyzowanych matryc naprawczych HDR (ang. homology directed repair template). Matryce te poza sekwencjami, które chcemy wprowadzić i/lub zmienić powinny zawierać odcinki flankujące o długości ok. 300-600 pz, które są homologiczne z sekwencjami docelowymi w genomie modyfikowanego gospodarza. Dostępność tak przygotowanych matryc HDR pozwala na uruchomienie mechanizmów naprawy DNA wykorzystujących mechanizmy rekombinacji homologicznej (HDR, ang. homology directed repair).
Firma Takara Bio wychodząc naprzeciw oczekiwaniom swoich klientów posiada w swojej ofercie szerokie portfolio produktów, które pozwalają na przeprowadzenie wszystkich etapów wymaganych podczas edycji genów z wykorzystaniem metody CRISPR/Cas.
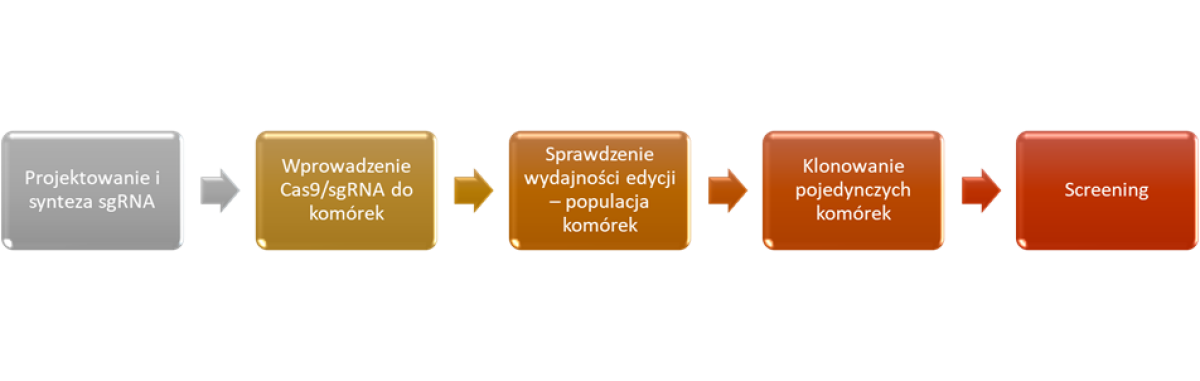
Rysunek 1. Workflow edycji genów z wykorzystaniem metody CRISPR/Cas.
Jedną z kluczowych metod dostarczania do komórek biorców sekwencji kodujących sgRNA oraz aktywne białko Cas9 jest zastosowanie Lentiwirusów. To właśnie im poświęcona będzie druga część wykładu.
Lentiwirusy są często wykorzystywane w inżynierii genetycznej jako skuteczne narzędzie do wprowadzania i edytowania genów w komórkach ssaczych. Ich zdolność do trwałej integracji z genomem gospodarza oraz wysoką efektywność transdukcji sprawia, że są szeroko stosowane w badaniach biologicznych i medycynie regeneracyjnej. Lentiwirusy należą do rodziny retrovirusów i charakteryzują się zdolnością do infekowania zarówno dzielących się, jak i nieproliferujących komórek. Kluczowymi cechami, które czynią je idealnym narzędziem do edycji genów, są:
- Trwała integracja z genomem gospodarza,
- Wysoka skuteczność transdukcji w różnych typach komórek,
- Możliwość przenoszenia stosunkowo dużych fragmentów DNA,
- Zdolność do infekowania komórek zarówno in vitro, jak i in vivo.
Edycja genów z wykorzystaniem tego niezwykle precyzyjnego i wydajnego systemu obejmuje kilka stałych i charakterystycznych etapów – tzw. workflow.
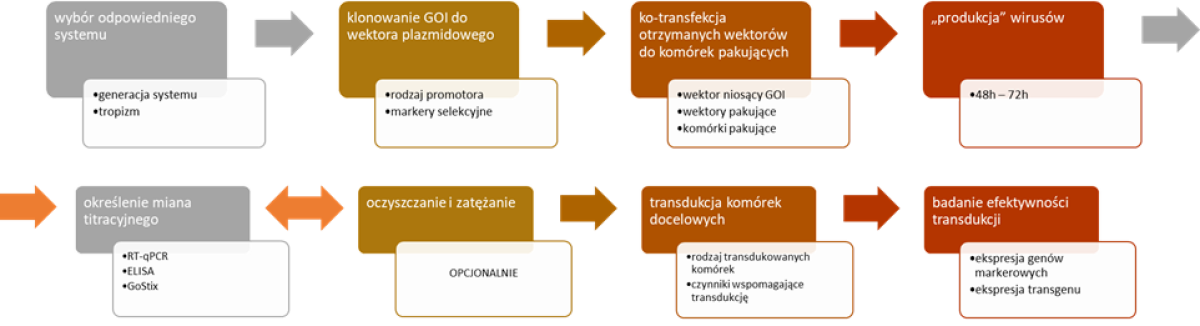
Rysunek 2. Workflow edycji genów z wykorzystaniem systemów Lentiwirusowych.
Jeśli chcesz dowiedzieć się więcej o rozwoju technik związanych z systemami Lentiwirusowymi zapraszamy do odwiedzenia naszej strony internetowej i zapoznania się z artykułem – Czy stała nadekspresja genów, wprowadzona poprzez system lentiwirusowy, jest wciąż popularnym narzędziem biotechnologów?
Podczas wykładu omówione zostaną rozwiązania Takara Bio oferowane w kontekście pracy z systemami Lentivirusowymi ze szczególnym naciskiem na zastosowanie tych układów wirusowych w CRISPR/Cas9.
Jak wspomniano, Lentiwirusy charakteryzują się trwałą integracja z genomem gospodarza, w której ekspresja transportowanych genów realizowana jest pod kontrolą promotorów konstytutywnych. Pomimo licznych zalet, rozwiązanie to ma również kilka wad. Najważniejszą z nich, w kontekście ekspresji genów kodujących endonukleazę Cas9, jest stałe obciążenie metaboliczne transdukowanych komórek oraz możliwość niespecyficznego działania Cas9. Takara Bio oferuje doskonały system Lenti-X™ Tet-On® 3G CRISPR/Cas9 System, który pozwala na rozwiązanie ww. problemu. W tym przypadku ekspresja kluczowego dla CRISPR/Cas enzymy indukowane jest przez dodatek doksycykliny.
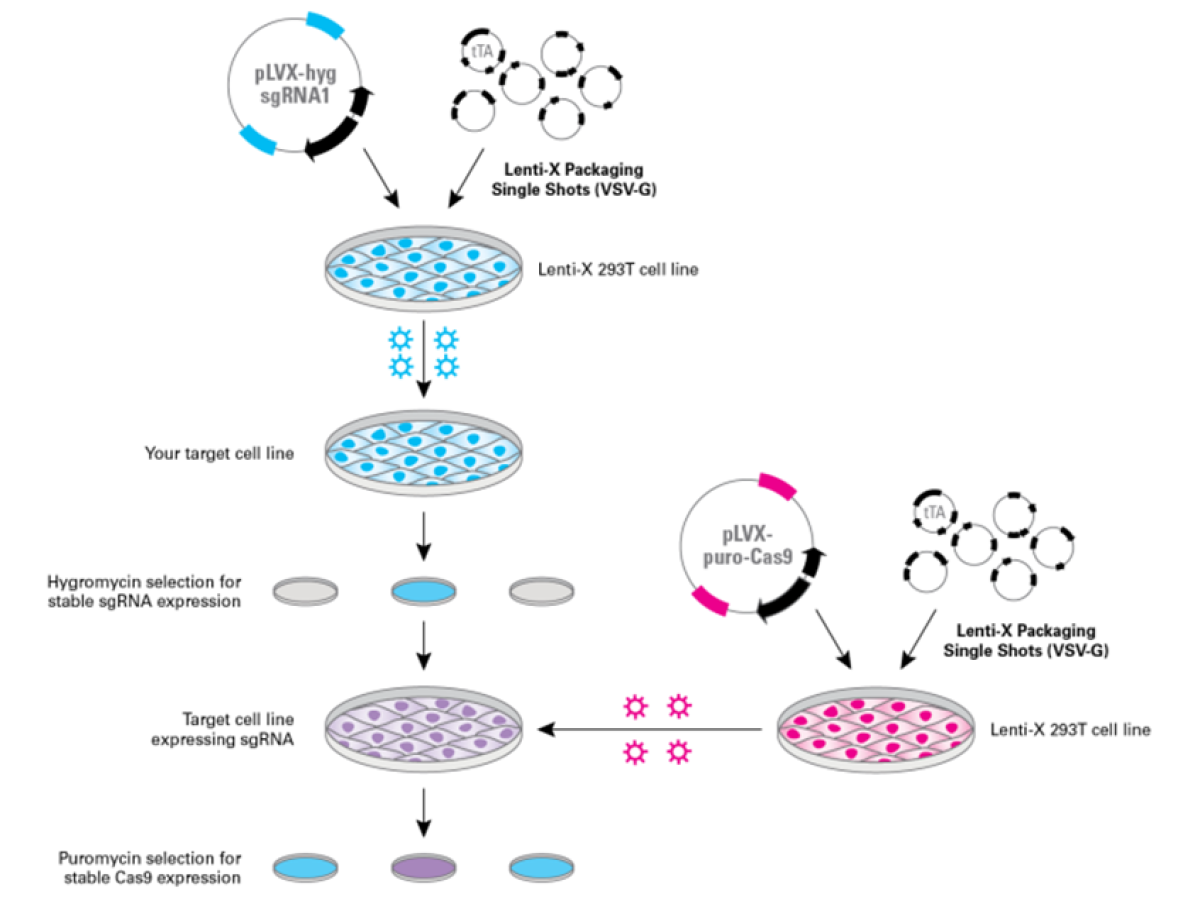
Rysunek 3. Uproszczony schemat przygotowania komórek eksprymujących sgRNA oraz Cas9 z wykorzystaniem Lenti-X™ CRISPR/Cas9 System.
Wspomniane powyżej produkty oraz rozwiązania to jedynie ułamek tego co może zaoferować Państwu Biokom, oficjalny dystrybutor Takara Bio w Polsce. Po wiele więcej zapraszamy na wykład!