Antybiotyki – cenne narzędzie biotechnologiczne wykorzystywane nie tylko w walce z chorobami
Artykuł obejmuje zagadnienia:
- Co to jest antybiotyk?
- Historia odkrycia antybiotyków i ich klasyfikacja w oparciu o zakres działania i syntezę
- Jak działają antybiotyki? Jakie są rodzaje antybiotyków?
- Oporność bakterii na antybiotyki. Co jest w planach NPZ Polski?
- Jak wygląda wykonanie antybiogramu?
- Odpowiedzialne stosowanie antybiotyków
- Antybiotyki a mikrobiom
- Jak stosowane są antybiotyki w biotechnologii?
- Antybiotyki w hodowli komórkowej
- Zakażenia hodowli komórkowych Mykoplazmą
Co to jest antybiotyk?
Antybiotyki to substancje, które zmieniają przebieg wielu chorób zagrażających życiu, dając nam narzędzie do zwalczania infekcji bakteryjnych. Pomimo ich niezaprzeczalnych korzyści, niewłaściwe stosowanie antybiotyków prowadzi do narastającego problemu oporności bakterii, co stanowi jedno z głównych wyzwań współczesnej medycyny. Warto też zwrócić uwagę, że z punktu widzenia biotechnologii zdolność przetrwania danej presji antybiotykowej jest niezrównanym markerem np. powodzenia klonowania.
Historia odkrycia antybiotyków i ich klasyfikacja w oparciu o zakres działania i syntezę
Początek ery antybiotyków datuje się na rok 1928, kiedy to Alexander Fleming odkrył działanie penicyliny uzyskanej z grzyba kropidlaka (Aspergillus oryzae) na bakterie.
Podczas porządkowania naczyń z kulturami bakterii, zauważył kolonię pleśni, która zabijała bakterie. Przeprowadził kolejne eksperymenty i odkrył, że pleśń ta zawiera substancję, która niszczy bakterie. Odkrycie to zrewolucjonizowało medycynę i przyczyniło się do jej ogromnego postępu w XX wieku.
Od tamtej pory wiele różnych antybiotyków zostało odkrytych i wprowadzonych do praktyki medycznej, ratując miliony życia na całym świecie. Aktualnie stosuje się terapie lekami, które są kombinacjami kilku antybiotyków jako substancji czynnych. Można też wyróżnić wśród nich rodzaje antybiotyków zależnie od ich działania na bakterie gram (+) lub gram (-) (wąskie spektrum działania) lub aktywne przeciw jednocześnie bakteriom gram (+) i gram (-) (szerokie spektrum działania).
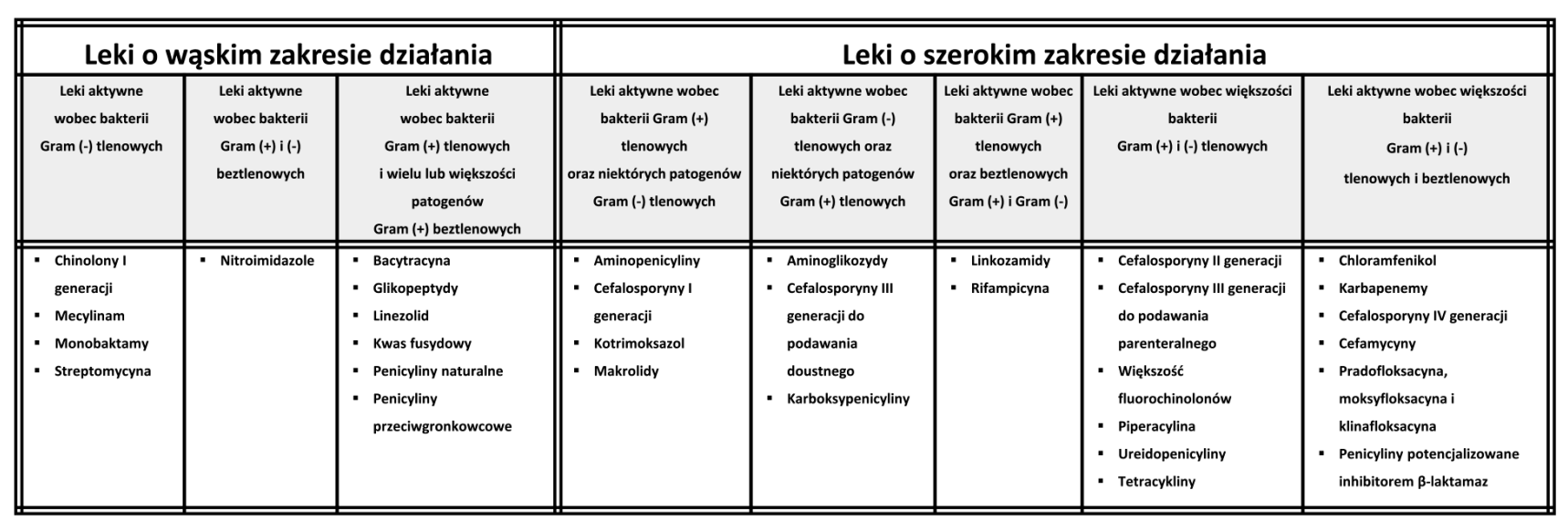
Podział antybiotyków zależnie od ich spektrum działania. Posługując się terminem „szerokie spektrum działania” ma się na myśli chemioterapeutyki, które działają zarówno na bakterie Gram-dodatnie jak i Gram-ujemne tlenowe, choć nie jest to regułą; pojęcie „szeroki zakres działania” jak widać z powyżej jest bardzo względny i nieprecyzyjny. Zwykle do leków o szerokim zakresie działania zalicza się również makrolidy [a więc leki które działają na tlenowce i beztlenowce Gram-dodatnie i na niektóre bakterie Gram-ujemne oraz na zarazki atypowe (Chlamydia, Mycoplasma)] oraz linkozamidy (a więc leki aktywne wobec beztlenowców oraz Gram-dodatnich tlenowców a nieaktywne względem Gram-ujemnych tlenowców), choć niektórzy autorzy klasyfikują je jako antybiotyki o wąskim spektrum. Do leków o szerokim zakresie działania nie zaliczamy takich, które działają wyłącznie na bakterie beztlenowe (nitroimidazole), ponieważ bakterie te nieporównanie rzadziej wywołują zakażenia, w porównaniu do zarazków tlenowych. Uwaga! Powyższego zestawienie stanowi znaczne uproszczenie i należy podchodzić do niego z dystansem, gdyż istnieje od niego wiele wyjątków, np. tylozyna (antybiotyk makrolidowy) jest aktywna wobec Brachyspira hyodysenteriae (powoduje dyzenterię świń), a więc bakterii Gram (-) beztlenowej. Wiele z wymienionych w tabeli związków to antybiotyki bakteriostatyczne. Niektóre antybiotyki trudno przyporządkować tylko do jednego rodzaju. [źródło T.M. Antybiotykoterapia praktyczna]
Jeśli interesuje Cię ten temat pobierz pełną listę naszych antybiotyków.
Stosuje się także klasyfikację w oparciu o ich strukturę i syntezę. Możemy wyróżnić:
- Antybiotyki naturalne stanowiące produkt metabolizmu drobnoustrojów m.in. innych bakterii, grzybów, porostów.
Należą tu m.in.: penicylina benzylowa, fenoksymetylowa, a ponadto glikopeptydy i niektóre makrolidy (np. erytromycyna). - Antybiotyki półsyntetyczne będące pochodnymi antybiotyków naturalnych, chemicznie zmienione w toku modyfikacji. Należą tu m.in. penicyliny półsyntetyczne, cefalosporyny i niektóre makrolidy (np. azytromycyna).
- Antybiotyki syntetyczne stanowią syntetyczne analogii antybiotyków naturalnych. Powstają w wyniku pełnej syntezy chemicznej w laboratorium. Należy tutaj m.in. chloramfenikol, który naturalnie jest wytwarzany przez promieniowce z rodzaju Streptomyces venezuelae, ale dla celów medycznych jest pozyskiwany wyłącznie syntetycznie.
[źródło T.M. Antybiotykoterapia praktyczna]
Jak działają antybiotyki? Jakie są rodzaje antybiotyków?
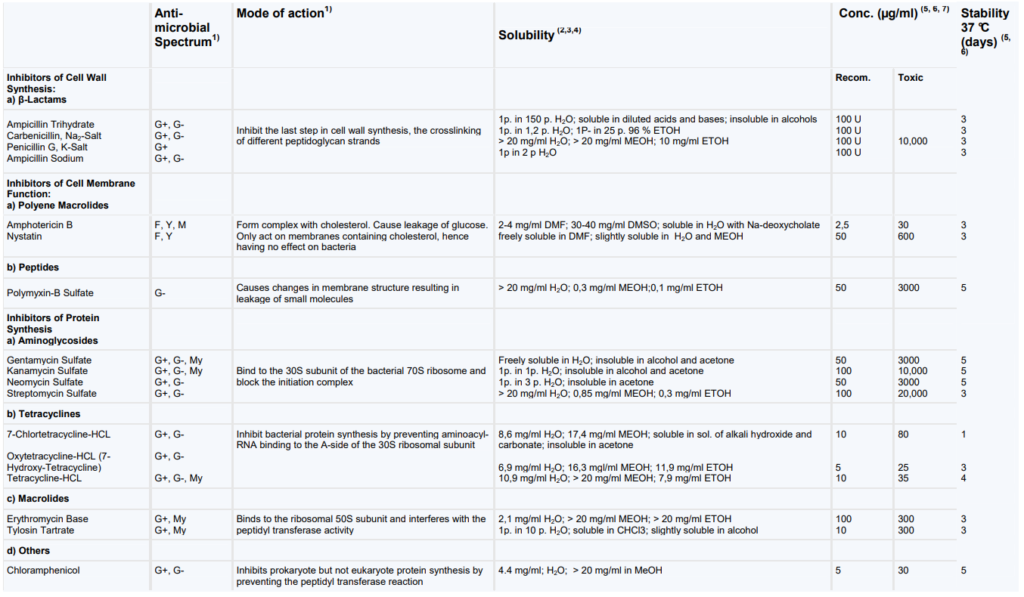
Mechanizmy działania antybiotyków są różne. Na podstawie ich budowy i wywieranego wpływu stworzono wiele klasyfikacji. Niektóre związki zaburzają strukturę ściany komórkowej bakterii, inne blokują procesy życiowe bakterii – blokują syntezę białka czy inhibiują replikację DNA. I tak na przykład antybiotyki β-laktamowe wywierają efekt w postaci blokady syntezy ściany komórkowej, fluorochinolony powodują zakłócanie syntezy kwasów nukleinowych, aminoglikozydy perforują błonę cytoplazmatyczną działając bakteriobójczo. Natomiast tetracykliny powodują zakłócanie syntezy białek spowalniając namnażanie bakterii (efekt bakteriostatyczny) Tab2.
Dokładny podział antybiotyków, mechanizm działania, pochodzenie możesz znaleźć w naszym przeglądzie antybiotyków oraz Tab5.
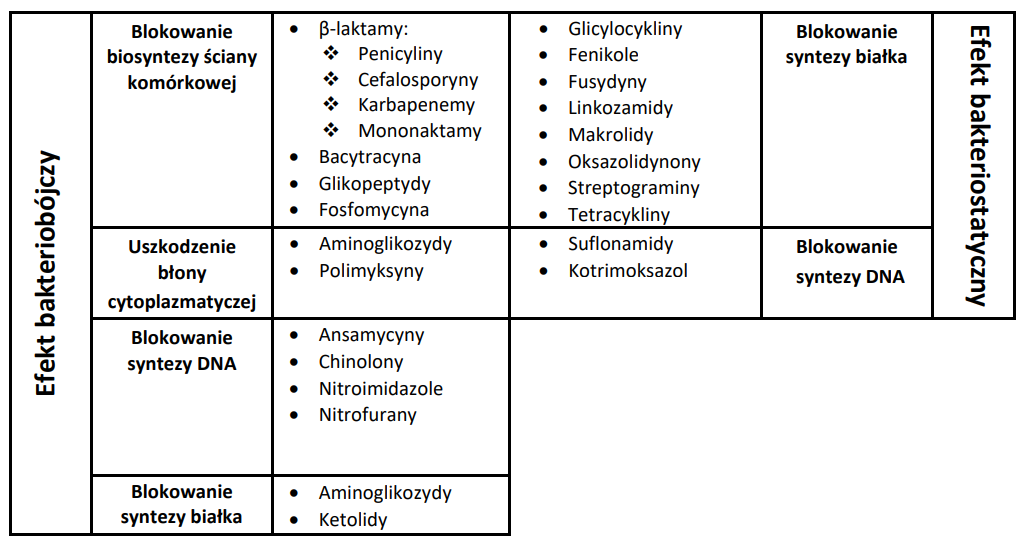
Podział antybiotyków zależnie od sposobu ich działania. [źródło T.M. Antybiotykoterapia praktyczna]
Jeśli interesuje Cię ten temat pobierz pełną listę naszych antybiotyków.
Oporność bakterii na antybiotyk. Co jest w planach NPZ Polski?
Jednym z poważnych problemów, z którym obecnie się borykamy, jest oporność bakterii na antybiotyki. Kiedy nadużywamy antybiotyków lub nie stosujemy ich zgodnie z zaleceniami lekarza, tworzymy środowisko, w którym bakterie mogą się adaptować i stawać się odporne na leki. Oporne szczepy bakterii stanowią poważne zagrożenie, ponieważ mogą prowadzić do infekcji, które są trudne lub niemożliwe do leczenia.
Warto przy rozważaniu zagadnienia pamiętać o takim zjawisku jak poziomy transfer genów (horyzontalny transfer genów HTG; lateralny transfer genów LTG). Komórki bakterii przekazują innym m.in. rodzajom bakterii uzyskaną lub zdobytą oporność antybiotykową. W wyniku również tego zjawiska może dochodzić do kumulacji mutacji zapewniających oporność na chemioterapeutyki, wytworzenia tzw. „super bakterii”.
Według Światowej Organizacji Zdrowia (WHO), w 2019 roku z powodu zakażeń lekoopornymi bakteriami zmarło 1,2 miliona osób, a kolejne 5 milionów zmarło przy współudziale takich zarazków. Najczęściej wykrywanymi gatunkami bakterii, które wykształcały lekooporność były: Escherichia coli, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae oraz Salmonella spp. W Polsce, w 2018 roku, pojawił się szczep bakterii Klebsiella pneumoniae typu OXA-4, który jest odporny na wszystkie antybiotyki [źródło: medonet .pl]
Antybiotykooporność / lekooporność bakterii, stała się problemem globalnym. Coraz częściej słyszy się o powstawaniu bakterii opornych na antybiotyki tzw. ostatniego rzutu (czyli najnowszych, nie tak powszechnych w użyciu jak inne). Dlatego krajowe Narodowe Programy Zdrowia zakładają podejmowanie konkretnych kroków w celu ograniczania użycia tych związków w powszechnym użyciu. Narodowy Program Zdrowia (NPZ) Polski określający cele i priorytety polityki zdrowotnej państwa na lata 2021-2025 zakłada m.in:
- Wspieranie racjonalnego stosowania antybiotyków w medycynie, weterynarii i rolnictwie
- Monitorowanie zużycia antybiotyków i występowania opornych szczepów bakterii
- Wdrażanie skutecznych metod diagnostyki, profilaktyki i leczenia zakażeń
- Promowanie świadomości społecznej na temat zagrożeń związanych z nadużywaniem antybiotyków
- Współpracę międzynarodową w zakresie zwalczania lekooporności
Aby ustalić, czy bakterie są oporne na dany antybiotyk wykonuje się tzw. antybiogram, czyli test pozwalający na określenie na jaki antybiotyk wrażliwy jest szczep/izolat, aby dobrać tzw. leczenie celowane. W przypadku niektórych szczepów ich oporność na dany antybiotyk jest już od dawna znana, lub wytworzona dlatego lekarze przepisują w trakcie leczenia antybiotyki oznaczone jako jeszcze skuteczne. Dokładny podział antybiotyków, mechanizm działania, wrażliwość bakterii, pochodzenie możesz znaleźć w naszym przeglądzie antybiotyków.
Jak wygląda wykonanie antybiogramu?
Najczęściej stosuje się posiewy na podłożu agarozowym stałym, na złożach zawierających w składzie dany antybiotyk. Przygotowuje się więc kilka płytek z antybiotykami z różnych grup i dokonuje wysiewu z pobranego wymazu lub próbki.
Można też stosować krążki antybiotykowe, czyli zapewnia się sprzyjające wzrostowi bakterii warunki i umieszcza się na powierzchni płytki krążki nasączone danymi antybiotykami i hoduje w cieplarce.
W obu protokołach obserwuje się wzrost kolonii lub jego brak po upływie około 16-24 h hodowli.
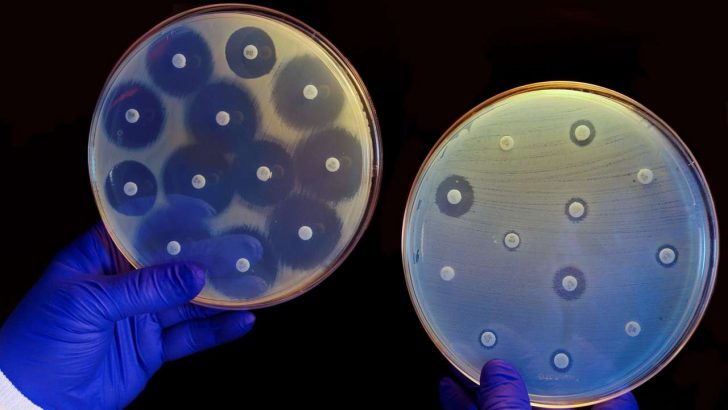
Posiewy takie są dość żmudne i długotrwałe, zwłaszcza gdy zagrożone jest życie pacjenta np. z podejrzeniem SEPSy, czyli ogólnoustrojowego zakażenia. Zapewniają jednak dość wyrazistą odpowiedź.
Testy molekularne angażujące np. qPCR, do analizy oporności antybiotykowej pomimo swojej szybkości mogą okazać się zawodne, gdyż z technicznych względów, pozwalają na wykrycie konkretnej zmiany w sekwencji kasety. Jak zostało wspomniane wcześniej zmian w takiej sekwencji może być więcej niż jedna oraz mogą występować w wielu genach a przez to różnie wpływać na utratę wrażliwości bakterii na terapeutyk. Dlatego często stosuje się kilka-kilkanaście par starterów nacelowanych na potencjalnie najczęściej występujące zmiany.
ZOBACZ TAKŻE: Jak bakterie środowiskowe mogą nabywać lekooporności
Odpowiedzialne stosowanie antybiotyków
Odpowiedzialne stosowanie antybiotyków to klucz do przeciwdziałania oporności bakterii. Wyróżnia się 4 zasady stosowania antybiotyków:
- Przed przyjęciem antybiotyku zawsze skonsultuj się z lekarzem
- Przyjmuj antybiotyki tylko wtedy, gdy są one naprawdę potrzebne (nie na katar!)
- Zawsze stosuj się do zaleceń lekarza w kwestii dawkowania, czasu trwania kuracji oraz odstępu pomiędzy dawkami leku
- Nigdy nie używaj antybiotyków pozostałych z poprzedniej kuracji bez konsultacji z lekarzem
Ważne jest także, aby pamiętać, że antybiotyki skutecznie działają tylko na bakterie, a nie na wirusy – dlatego nie pomogą przy grypie czy przeziębieniu. Aby nie wpływać na aktywność tych substancji lepiej popijać je zawsze wodą niegazowaną.
Antybiotyki a mikrobiom
Nasz organizm jest siedliskiem dla niesamowitej różnorodności mikroorganizmów, które pełnią rolę w wielu kluczowych procesach, takich jak trawienie czy modulacja odpowiedzi immunologicznej. Antybiotyki, zwłaszcza z szerokiego spektrum, mogą zaburzać delikatną równowagę, eliminując nie tylko szkodliwe, ale także przyjazne dla nas bakterie. Bakterie wchodzące w skład pożytecznego dla nas mikrobiomu także mogą także nabywać oporności podczas niewłaściwie przyjmowanej antybiotykoterapii. W konsekwencji mogą stać się rezerwuarem tej oporności dla nowoinfekujących patogenów.
Dlatego ważne jest, aby po odpowiedzialnie stosowanej kuracji antybiotykowej, zadbać dbać o odbudowę świeżej flory bakteryjnej, np. poprzez spożywanie probiotyków lub stosować osłonę przyjmując antybiotyk.
Jak stosowane są antybiotyki w biotechnologii?
Antybiotyki odgrywają kluczową rolę nie tylko w medycynie, ale również w biotechnologii. W tej dziedzinie są wykorzystywane przede wszystkim do selekcji genetycznie modyfikowanych organizmów. Kiedy wprowadzany jest nowy gen do komórki, antybiotyki stosowane są, aby upewnić się, że tylko te komórki, które prawidłowo przyjęły gen, przeżyją jego presję i będą rosnąć. Takie zastosowanie ma np. ampicylina podczas klonowania plazmidów i transformacji E.coli.
Plazmidy tzw. wahadłowe (shuttle vectors), to konstrukty skonstruowane w taki sposób, aby mogły być transkrybowane w dwóch organizmach np. Saccharomyces cerevisiae, jak i Escherichia coli; E. coli i w ssakach. Takie wektory najczęściej są multiplikowane w jednym organizmie a wykorzystywane w drugim np. do nadprodukcji danego białka lub eksperymentów internalizacji genów. Często zawierają kasetę oporności na antybiotyk dla obu organizmów.
Kat. Nazwa Mapa Opis
631622 pIRESbleo3 Wektor jest przeznaczony do produkcji stabilnych linii komórkowych eksprymujących rekombinowane białka w komórkach ssaków. Wektor ten zawiera wewnętrzne miejsce wejścia rybosomu (IRES), które umożliwia syntezę zarówno genu, jak i markera selekcji bleomycyny z pojedynczego mRNA.
3244/ 3243 pBApo-EF1alpha Pur DNA/ Neo DNA Plazmid do ekspresji genów w komórkach ssaków. Wektor ten posiada promotor z ludzkiego promotora EF-1 alfa i sygnał poliA z kinazy tymidynowej wirusa opryszczki pospolitej. Docelowy gen można wklonować w MCS, a po transfekcji można wybrać stabilną integrację wektora za pomocą puromycyny/neomycyny.
3605 pAUR316 DNA Wektor wahadłowy E. coli – Aspergillus, który może się replikować
autonomicznie w A. nidulans. Posiada gen Aureobasidin A (AbA) gen odporności na Aureobasidinę A, aurAr, pochodzący z A. nidulans jako marker selektywny. AMA1 region A. nidulans jako źródło replikacji w komórkach Aspergillus, i gen oporności na ampicylinę, Ampr jako selektywny marker w E. coli
3600 pAUR101 DNA Wektor wahadłowy E. coli -drożdże, integrujący w chromosomy drożdżowe.
pAUR101 nie replikuje się autonomicznie w drożdżach, podlega integracji. Posiada
selektywny marker dla Saccharomyces cerevisiae.
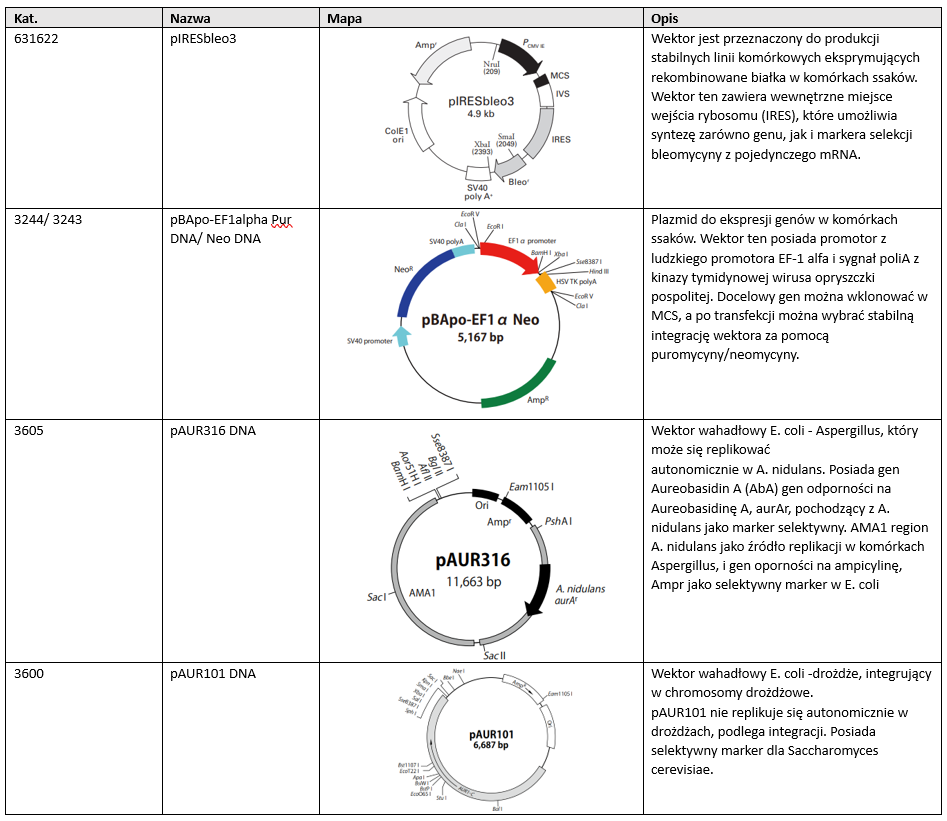
Przykładowe dostępne w naszej ofercie plazmidy wahadłowe (Escherichia coli/ssaki/Saccharomyces cerevisiae)

Zapytaj nas o inne plazmidy z kasetami oporności na antybiotyki.
Antybiotyki w hodowli komórkowej in vitro
Ponadto, antybiotyki są niezbędne w hodowli czystych kultur mikroorganizmów eliminując ryzyko kontaminacji.
W tym celu stosuje się także antybiotyki W hodowli komórek ssaczych in vitro, dodawane niemal rutynowo. Niektóre z najczęściej używanych antybiotyków to:
- Penicylina i streptomycyna – To najczęściej stosowane antybiotyki w hodowli komórek. Są one zwykle używane razem, aby działać przeciwko szerokiemu spektrum bakterii Gram-dodatnich i Gram-ujemnych. Dawkowanie zależy od konkretnych wymagań hodowli, ale często stosuje się je w stężeniu około 100 U/mL dla penicyliny i 100 μg/mL dla streptomycyny.
- Amfoterycyna B – Jest to antybiotyk przeciwgrzybiczy używany do zapobiegania kontaminacji grzybiczej. Znany jest również jako fungizon. Stosuje się go w bardzo niskich stężeniach, zwykle w zakresie od 0,25 do 2,5 μg/mL.
- Neomycyna – Inny antybiotyk szerokospektralny, który może być używany jako alternatywa lub dodatek do penicyliny i streptomycyny.
- Gentamycyna – Jest to antybiotyk działający głównie na bakterie Gram-ujemne. Może być używany jako alternatywa dla streptomycyny.
- Ciprofloksacyna – Jest to antybiotyk z grupy fluorochinolonów, który jest skuteczny przeciwko wielu bakteriom, w tym trudnym do zwalczenia patogenom.
- Tetracyklina – Czasami stosowana w specjalnych sytuacjach, ale nie jest tak powszechna jak powyższe.
Chociaż antybiotyki są przydatne w zapobieganiu kontaminacji, ich nadmierne stosowanie może prowadzić do problemów, takich jak rozwój oporności bakterii na antybiotyki lub zakłócanie normalnych funkcji komórek. Wielu badaczy stara się minimalizować użycie antybiotyków w hodowli komórek, stosując je tylko wtedy, gdy są absolutnie konieczne, lub korzystając z alternatywnych metod kontroli zanieczyszczeń. Przed dodaniem antybiotyków do hodowli komórek zawsze należy zapoznać się z odpowiednimi wytycznymi i literaturą, aby zapewnić właściwe dawkowanie i unikać potencjalnych problemów.
Zakażenia hodowli komórkowych Mykoplazmą
Częstym problemem podczas hodowli komórek ssaczych (in vito cel culture) są zakażenia Mykoplazmą (Mycoplasma infection).
Mykoplazma to rodzaj bardzo małych bakterii pozbawionych ściany komórkowej, co odróżnia je od wielu innych bakterii. Brak ściany komórkowej sprawia, że są naturalnie odporne na wiele antybiotyków, które działają poprzez niszczenie ściany komórkowej, takich jak penicylina. Zamiast tradycyjnej ściany komórkowej, mykoplazmy posiadają błonę lipidową. Bakterie są w środowisku patogenami dla ludzi, zwierząt i roślin. Mogą powodować m.in. zapalenie płuc, zapalenie cewki moczowej czy zapalenie stawów.
W kontekście hodowli komórek in vitro, kontaminacja mykoplazmą stanowi poważny problem, gdyż bakterie mogą wpływać na fizjologię komórek, ich wzrost, a także wpływać na wyniki eksperymentów, prowadząc do fałszywych wniosków. Ze względu na ich mały rozmiar i brak ściany komórkowej, trudno jest je wykryć standardowymi metodami mikroskopowymi czy tradycyjnymi antybiotykami. Istnieją jednak specjalne testy i zestawy przeznaczone do wykrywania mykoplazmy w hodowlach komórkowych.

Zapytaj nas o kity do wykrywania mykoplazmy.
W celu zapobiegania kontaminacji mykoplazmą w hodowli komórek, niezbędne jest przestrzeganie rygorystycznych procedur aseptycznych oraz regularne testowanie hodowli na obecność tego patogenu. Jeśli zostanie wykryta kontaminacja, hodowla jest zazwyczaj niszczona, chociaż istnieją też metody leczenia hodowli antybiotykami specyficznie skierowanymi przeciwko mykoplazmie.
W naszej ofercie znajdziesz i wiele dedykowanych rozwiązań. Do walki z mykoplazmą polecamy MycoDecon i Mycorase:
MycoDecon to bardzo skuteczny środek dezynfekujący powierzchnie, szczególnie aktywny przeciwko mykoplazmie, ale także przeciwko bakteriom, wirusom i grzybom. Jednym ze źródeł rozprzestrzeniania się mykoplazmy jest powstawanie aerozoli, które mogą pojawić się podczas pracy z zainfekowanymi komórkami. Dlatego ważne jest dokładne przecieranie odpowiednimi środkami powierzchni pokojów hodowlanych, inkubatorów, cieplarek, wirówek, pudełek na krioprobówki, elementów dewaru i innych sprzętów mających styczność z kulturami. MycoDecon jest roztworem na bazie alkoholu, niekorozyjnym i nierakotwórczym, który można łatwo rozpylać na wszystkie powierzchnie bez pozostawiania śladów.
Mycorase to wyspecjalizowany środek, antybiotyk opracowany specjalnie w celu eliminacji zakażenia mykoplazmą w większości linii komórkowych. Jest aktywny wobec szerokiego zakresu różnych szczepów mykoplazmy bez wpływu na proliferację komórek eukariotycznych. Gotowy do użycia roztwór 50x stężony o szerokim zakresie działania, pozwalający na trwałe usunięcie mikoplazmy.
Broszura Contamination-Free
Jeśli interesuje Cię ten temat pobierz pełną listę naszych antybiotyków.

Zapytaj nas o kit qPCR do wykrywania obecności bakterii szerokiego spektrum, bazujący na analizie obecności genu tuf. Pozwala na szybką analizę w przeciągu kilku godzin bez wykonywania posiewu. Doskonały do analizy kontaminacji bakteriami produktów spełniających standardy największej czystości np. leków, substancji czynnych, ekstraktów roślinnych i innych.

Tab5
Najczęściej wyróżniane rodzaje antybiotyków. Ich klasyfikacja opiera się o budowę cząsteczki. Po lewej przedstawiciele danej klasy.
Jeśli interesuje Cię ten temat pobierz pełną listę naszych antybiotyków.
Pobierz tabelę antybiotyków z opisem ich działania i klasyfikacją




