Nanocząsteczki lipidowe jako nośniki leków
02 Czerwca 2021 (Ostatnia aktualizacja 25.10.2024)
Formulacje na bazie lipidów przyczyniły się do znaczących osiągnięć w opracowywaniu leków oraz dostarczaniu terapeutycznych biomolekuł i genów. Ich konstrukcja może pomóc przezwyciężyć ograniczenia biodystrybucji i/lub biodostępności niektórych konwencjonalnych metod dostarczania leków, umożliwiając ukierunkowanie na specyficzne komórki oraz transport do określonych organelli, a także przedłużenie stabilności leku. Nanocząsteczki lipidowe można stosować do pakowania leków podawanych miejscowo, doustnie, dożylnie lub dopłucnie. Pierwszy lek na bazie lipidów zatwierdzony przez FDA, Doxil®, antybiotyk przeciwnowotworowy, został udostępniony w 1995 r. Od tego czasu na rynek wprowadzono siedemnaście kolejnych zatwierdzonych przez FDA produktów leczniczych stosowanych w leczeniu raka, chorób grzybiczych, analgezji oraz w terapii genowej, szczepieniach przeciwwirusowych i terapii fotodynamicznej. Setki innych jest w trakcie badań klinicznych, a część została już nawet dopuszczona do użytku w nagłych wypadkach - tak jak w przypadku szczepionek na COVID-19 firm Pfizer i Moderna. Największy postęp dokonał się jednak w dziedzinie dostarczania kwasów nukleinowych, obejmującej kapsułkowanie małego interferującego RNA (siRNA), mikroRNA (miRNA), małego aktywującego RNA (saRNA) lub informacyjnego RNA (mRNA) w nanocząsteczce lipidowej do wyciszania lub aktywacji genów i produkcji białek.
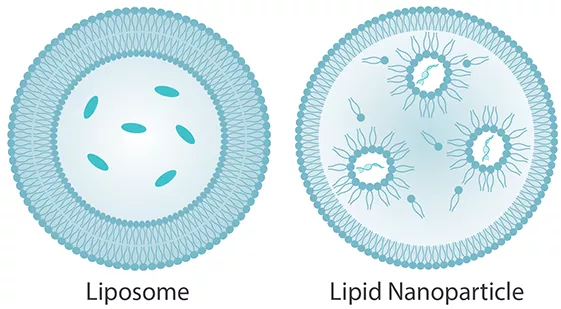
Tradycyjne liposomy charakteryzują się dwuwarstwą lipidową otaczającą wodny rdzeń. Nanocząsteczki lipidowe posiadają rdzeń o dużej gęstości elektronowej, w którym ulegające jonizacji lipidy kationowe są zorganizowane w odwrócone micele wokół kapsułkowanego materiału genetycznego
Zalety nanocząsteczek lipidowych
Nanocząsteczki lipidowe są kulistymi pęcherzykami - posiadającymi przynajmniej jedną dwuwarstwę lipidową z co najmniej jedną wewnętrzną komorą wodną - które przenoszą i dostarczają związek w stanie solubilizowanym w jednolitej dawce. Leki hydrofobowe mają powinowactwo do dwuwarstwy lipidowej, a leki hydrofilowe są zawarte w przestrzeni wodnej. Ochrona oferowana przez ten mechanizm dostarczania zwiększa biodostępność związków terapeutycznych poprzez kontrolowanie rozpuszczalności, przepuszczalności, wchłaniania, dystrybucji i metabolizmu. Te nanocząsteczki często zawierają modyfikacje powierzchni, takie jak dodanie ligandów lub polimerów, mające na celu rozszerzenie obszaru ich krążenia i poprawę specyficzności interakcji z komórką docelową. Dzięki celowaniu biernemu ten system dostarczania może poprawić profil toksyczności leku, zwiększając jego indeks terapeutyczny w porównaniu z konwencjonalnymi preparatami. Ponadto nanocząsteczki na bazie lipidów umożliwiają dostarczanie trudniejszych do podawania leków, takich jak RNA, które napotykają przeszkody w dotarciu do miejsca działania lub są podatne na niestabilność, degradację za pośrednictwem nukleaz, czy silną odpowiedź immunologiczną.
Klasy nanocząsteczek lipidowych
Liposomy stanowią duży podzbiór nanocząsteczek zbudowanych z lipidów i składają się z fosfolipidów lub syntetycznych amfifilów, które są interkalowane sterolami, takimi jak cholesterol, co pozwala wpływać na strukturę błony, jej stabilność, przepuszczalność oraz fuzję. Mogą one tworzyć struktury jednowarstwowe lub wielowarstwowe. Innym podzbiorem podobnym do liposomów są nanocząsteczki lipidowe (LNP), które są szeroko stosowane do dostarczania kwasów nukleinowych. Różnią się od liposomów przede wszystkim obecnością struktur micelarnych w rdzeniu cząstek. Pęcherzyki złożone ze sfingomieliny i cholesterolu, zwane optisomami lub sfingosomami, również opracowuje się tak, aby zawierały określone leki, podobnie jak wirosomy, które zawierają inaktywowane białka wirusowe interkalowane w dwuwarstwie fosfolipidowej.
Komponenty strukturalne nanocząsteczek lipidowych
Metoda zastosowana do przygotowania nanocząsteczek lipidowych ma kluczowe znaczenie dla określenia rozmiaru i skuteczności kapsułkowania pęcherzyków. Składniki lipidowe rozpuszcza się w rozpuszczalniku organicznym w określonych proporcjach, podczas gdy część ładunku rozpuszcza się w roztworze wodnym. Te dwa rozpuszczalniki są łączone, po czym pęcherzyki samoorganizują się i mogą być filtrowane do żądanej wielkości. Wiele czynników wpływa na określenie, które kombinacje lipidów, współrozpuszczalników i środków powierzchniowo czynnych są wybierane. Te zmiany formulacji określają wielkość, skład, ładunek, przemianę termiczną, przepuszczalność i lamelarność liposomu. Nici polimerów, takich jak glikol polietylenowy (PEG), można wprowadzić do systemu poprzez PEGylację w celu polepszenia indeksu terapeutycznego. Na przykład PEG kowalencyjnie połączony z liposomem może zmniejszyć immunogenność i antygenowość, chroniąc go przed układem makrofagów biorcy przeszkolonym do niszczenia obcych substancji. Dodanie PEG może również zmienić właściwości fizykochemiczne, zmniejszając klirens nerkowy i wydłużając czas krążenia, tym samym zmniejszając częstotliwość dawkowania. Dodanie ulegającego jonizacji lipidu kationowego umożliwia interakcje z zawartością naładowaną ujemnie, taką jak materiał genetyczny lub ujemnie naładowane składniki błony komórkowej lub ze specyficznymi białkami eksponowanymi na błonie komórkowej komórki docelowej. I odwrotnie, wprowadzenie anionowych lipidów ułatwia interakcję z dodatnio naładowaną zawartością. Włączenie termoczułych lipidów umożliwia zależne od temperatury uwalnianie kapsułkowanego związku. LNP zazwyczaj składają się z kationowych lub ulegających jonizacji lipidów, fosfolipidów, cholesterolu i PEGylowanych lipidów. Jonizowalne LNP są dobrze przystosowane do dostarczania terapii kwasami nukleinowymi, ponieważ mają prawie neutralny ładunek przy fizjologicznym pH, ale uzyskują ładunek w kwaśnych przedziałach endosomalnych, sprzyjając ucieczce endosomalnej do dostarczenia wewnątrzkomórkowego.
Dostępne produkty
Oparte na lipidach nanocząsteczki zaprojektowane do dostarczania leków wykazują ogromny potencjał w pokonywaniu ograniczeń konwencjonalnie formułowanych leków, zwiększając ich skuteczność terapeutyczną. Na wczesnych etapach projektowania leków należy jednak pamiętać, że przed wprowadzeniem do badań klinicznych składniki zawarte w formulacjach opartych na lipidach muszą spełniać wymogi regulacyjne, przechodząc obszerne profile bezpieczeństwa i toksyczności. Cayman wspiera te przedkliniczne programy rozwoju leków, oferując poniższe narzędzia badawcze, a także usługi kontraktowe w zakresie niestandardowej syntezy lipidów.
PEGylowane lipidy:
Fosfolipidy anionowe:
Kwasy fosfatydowe:
Fosfoseryny:
Fosfoglicerole
Lizofosfoglicerole:
Lipidy kationowe:
Fosfolipidy neutralne:
Fosfocholiny:
Lizofosfocholiny :
Fosfoetanoloamina:
Lizofosfoetanoloaminy:
Sterole:
Glicerolipidy:
Materiały do pobrania:
- DSPE-MPEG2000-sodium-salt-1
- DMG-PEG2000-1
- DSPE-PEG2000-amine
- Dihexadecyl-Phosphate
- Phosphatidylinositols-plant-wheat-germ-sodium-salt
- Phosphatidylinositols-soy-sodium-salt
- Phosphatidic-Acids-egg-ammonium-salt
- 12-Dimyristoyl-sn-glycero-3-phosphate-sodium-salt
- 12-Dioleoyl-sn-glycero-3-PA-ammonium-salt
- 12-Dipalmitoyl-sn-glycero-3-phosphate-sodium-salt
- 1-Oleoyl-Lysophosphatidic-Acid
- Phosphatidylserines-bovine
- Phosphatidylserines-soy-sodium-salt
- 12-Dimyristoyl-sn-glycero-3-PS-sodium-salt
- 12-Dioleoyl-sn-glycero-3-PS-sodium-salt
- 12-Dipalmitoyl-sn-glycero-3-PS-sodium-salt
- 12-Dilauroyl-sn-glycero-3-PG-sodium-salt
- 12-Dimyristoyl-sn-glycero-3-PG-sodium-salt
- 12-Dioleoyl-sn-glycero-3-PG-sodium-salt
- 12-Dipalmitoyl-sn-glycero-3-PG-sodium-salt
- 1-Palmitoyl-2-oleoyl-sn-glycero-3-PG-sodium-salt
- 1-Myristoyl-2-hydroxy-sn-glycero-3-PG-sodium-salt
- 1-Palmitoyl-2-hydroxy-sn-glycero-3-PG-sodium-salt
- 1-Stearoyl-2-hydroxy-sn-glycero-3-PG-sodium-salt
- 1-Oleoyl-2-hydroxy-sn-glycero-3-PG-sodium-salt
- 12-Dioleoyl-3-trimethylammoniumpropane-chloride
- 12-Dilauroyl-sn-glycero-3-PC
- 12-Dimyristoyl-sn-glycero-3-PC
- 12-Dioleoyl-sn-glycero-3-PC
- 12-Dipalmitoyl-sn-glycero-3-PC
- 12-Distearoyl-sn-glycero-3-PC
- 12-Diphytanoyl-sn-glycero-3-PC
- 12-Diheptadecanoyl-sn-glycero-3-PC
- 1-Linoleoyl-2-Hydroxy-sn-glycero-3-PC
- 1-Palmitoyl-2-hydroxy-sn-glycero-3-PC
- 1-Stearoyl-2-hydroxy-sn-glycero-3-PC
- 12-Dimyristoyl-sn-glycero-3-PE
- 12-Dioleoyl-sn-glycero-3-PE
- 13-Dipalmitoyl-Glycero-2-PE
- Lysophosphatidylethanolamines-egg
- 1-Myristoyl-2-hydroxy-sn-glycero-3-PE
- 1-Stearoyl-2-hydroxy-sn-glycero-3-PE
- Cholesterol
- Cholesteryl-Myristate
- Cho-Arg-trifluoroacetate-salt
- 2H-Cho-Arg-trifluoroacetate-salt
- DC-Chol-hydrochloride
- DMHAPC-Chol
- DMPAC-Chol
- Dios-Arg-trifluoroacetate-salt
- HAPC-Chol
- OH-C-Chol
- MHAPC-Chol
- 123-Tridocosanoyl-Glycerol
- 123-Trilauroyl-Glycerol
- 123-Tripalmitoyl-Glycerol
- 123-Tristearoyl-Glycerol