TeSR™ najczęściej cytowane podłoże do hodowli komórek macierzystych
21 Września 2021 (Ostatnia aktualizacja 31.10.2024)
Poznaj najczęściej cytowane podłoże do hodowli komórek macierzystych TeSR™ i wybierz to, które jest dla Ciebie najwłaściwsze.
mTeSR™ Plus
(# 100-0276 - 500 ml)
Najbardziej zaawansowane technologicznie, zdefiniowane, wolne od surowicy podłoże hodowlane do uzyskania spójnych hodowli ludzkich pluripotencjalnych komórek macierzystych (hPSC) o homogennym, niezróżnicowanym fenotypie.
mTeSR™ Plus oparta jest na udoskonalonej formule pożywki mTeSR™1 (#85850) - najszerzej publikowanej pożywki do hodowli komórkowej dla hPSC.
Udoskonalenie polega min. na ustabilizowaniu krytycznych składników pożywki, w tym FGF2 oraz na lepszym buforowaniu pH. Dzięki temu mTeSR™ Plus można używać w hodowlach uwzględniających codzienną wymianę podłoża, jak również nieprzerwaną hodowle bez wymiany podłoża przez (2-3 dni) zapewniając wciąż doskonałą morfologię hodowli i charakterystykę wzrostu komórek.
mTeSR™ Plus jest kompatybilna z Corning® Matrigel® hESC-Qualified Matrix, jaki i Vitronectin XF™ (# 07180).

mTeSR™1
(# 85850 - 500ml, # 85857 - 1l)
Specjalistyczne podłoże hodowlane do uzyskania spójnych hodowli ludzkich pluripotencjalnych komórek macierzystych (hPSC) o homogennym, niezróżnicowanym fenotypie.
Produkowane w standardzie cGMP, zapewnia najwyższą jakość, zapewniając powtarzalne wyniki zarówno w badaniach podstawowych, w terapii komórkowej i eksperymentach badawczych nad nowymi lekami.
mTeSR™1 to najczęściej publikowana pożywka hodowlaną hPSC. Dzięki ogromnej liście cytacji, dostępne są gotowe protokoły do różnych zastosowań, od pozyskiwania komórek macierzystych po ich różnicowanie.
mTeSR™1 wykorzystywane jest przez czołowych badaczy do utrzymywania tysięcy linii hPSC w ponad 50 krajach.
TeSR™-E8™
(# 05990 - 1l)
Wolna od komponentów obcych gatunkowo pożywka hodowlana dla ludzkich embrionalnych komórek macierzystych (ES) i ludzkich indukowanych pluripotencjalnych komórek macierzystych (iPS).
Skład TeSR™-E8™ opiera się na formule E8 opracowanej przez laboratorium dr Jamesa Thomsona (Uniwersytet Wisconsin-Madison) - wiodącą grupę badawczą stojącą za zaprojektowaniem mTeSR™1 - najszerzej publikowanej pożywki hodowlanej dla pluripotencjalnych komórek macierzystych.
Podobnie jak mTeSR™1, podłoże TeSR™-E8™ jest wytwarzane z zachowaniem najwyższej jakości i dbałości. Zawiera tylko podstawowe składniki wymagane do utrzymania komórek ES i iPS, zapewniając prostsze podłoże do hodowli pluripotencjalnych komórek macierzystych.
TeSR™-E8™ można stosować z macierzą Corning® Matrigel® zakwalifikowaną do hESC (# 07181) lub, w przypadku całkowicie zdefiniowanego systemu wolnego od komponentów odzwierzęcych, z Vitronectin XF™ (# 07180) jako macierz kultury.
Przykładowe dane porównawcze użycia pożywek TeSR™.
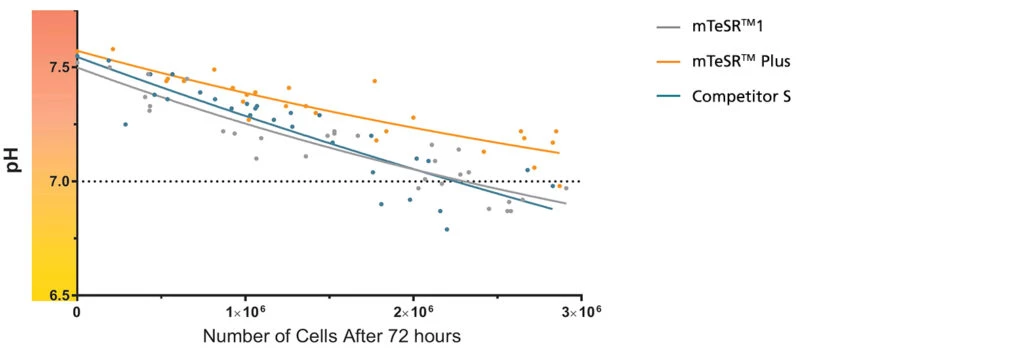
Wykres 1. mTeSR™ Plus utrzymuje optymalny poziom pH przez cały okres trwania protokołu Weekend-Free.
pH zużytej pożywki z hPSC hodowanych w mTeSR™ Plus jest wyższe niż w przypadku hPSC hodowanych w mTeSR™1 i innych pożywkach zapewniających elastyczny sposób odżywiania (czyli dopuszczający niecodzienną wymianę pożywki hodowlanej) przy podobnych gęstościach komórek. pH i liczbę komórek mierzono po 72 godzinach bez wymiany podłoża. Przedstawiony zakres liczb komórek reprezentuje różne gęstości, które byłyby obserwowane podczas typowego pasażu. Dane pokazują to, że używając mTeSR™ Plus można pominąć wymianę pożywki hodowlanej przez dwa kolejne dni podczas rutynowej hodowli, zapewniając przy tym prawidłowy wzrost i zachowując pH powyżej bezpiecznej wartości 7,0.
Uwaga: Wszystkie testowane hodowle, umieszczono w podwójnej, w stosunku do standardowej, objętości odpowiedniej pożywki, zanim rozpoczęto okres 72 godzin bez wymiany pożywki. Prezentowane liczby komórek pochodzą z jednego dołka płytki 6-dołkowej.
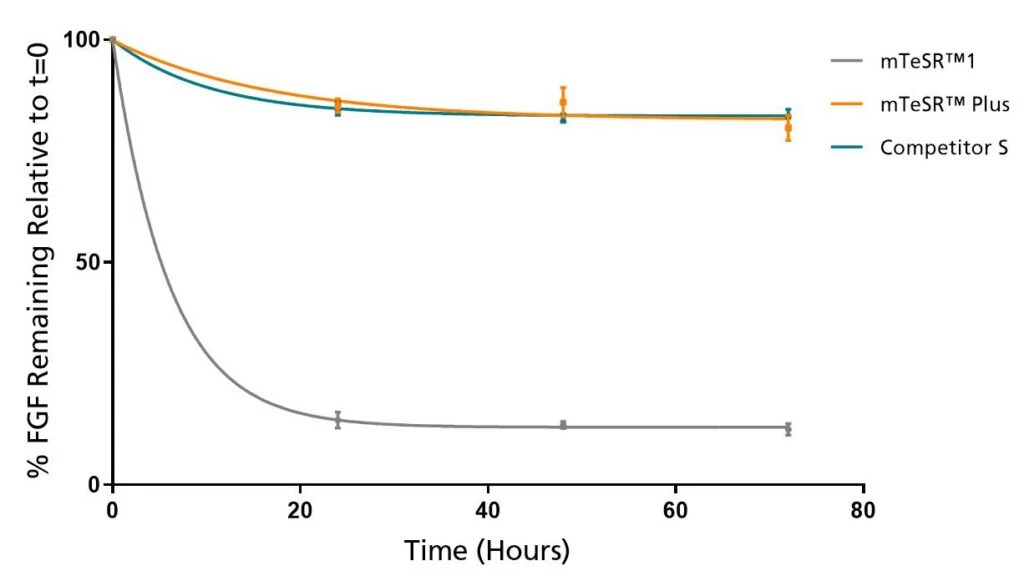
Wykres 2. mTeSR™ Plus utrzymuje stałe poziomy FGF2 przez cały czas trwania protokołu Weekend-Free
Poziomy FGF2 pozostają wysokie w mTeSR™ Plus podczas hodowli w 37°C przez okres 72 godzin. Mierzone techniką ELISA.
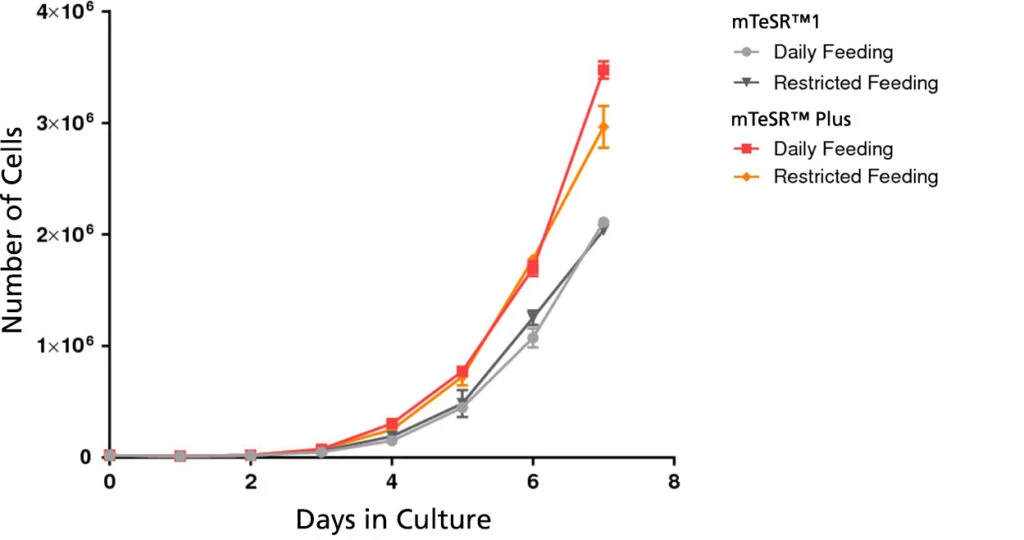
Wykres 3. mTeSR™ Plus wspera hodowle wyższe liczby komórek
Krzywe wzrostu otrzymano dla ludzkich komórek ES (H9) hodowanych w mTeSR™1 lub mTeSR™ Plus na matrycy Corning® Matrigel® przez 7 dni z uwzględnieniem wymiany pożywki codziennie, lub co drugi dzień. Krzywe wzrostu określono wysiewając 20 000 komórek na dołek 6-dołkowej płytki jako agregaty i zliczając liczbę komórek każdego dnia, uśredniając wartość z dwóch dołków .
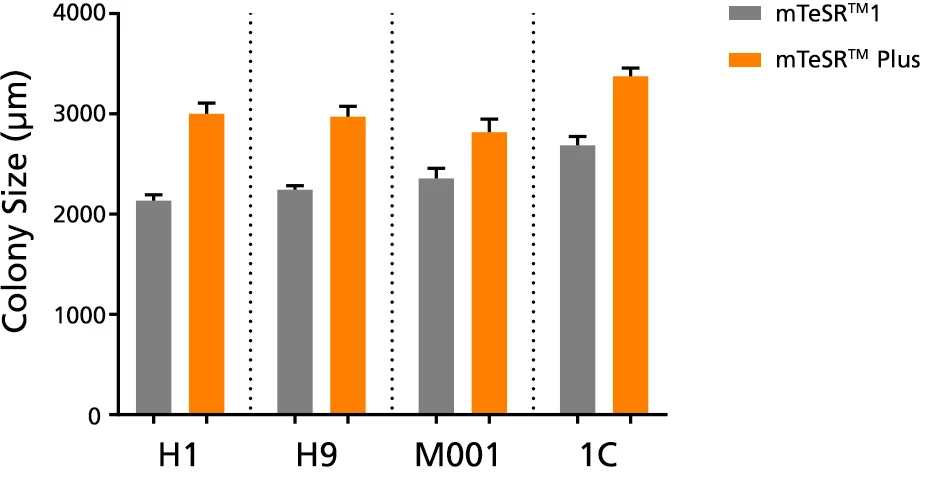
Wykres 4. W kulturach mTeSR™ Plus obserwuje się większe kolonie
Średni rozmiar kolonii na pasaż (± SEM) uzyskano dla ludzkich komórek ES (H1, H9) i iPS (STiPS-M001, WLS-1C) hodowanych w mTeSR™1 (codzienna wymiana podłoża) lub mTeSR™ Plus (odżywianie ograniczone) na Corning® Matrigel® przez 10 pasaży. Wielkość określono mierząc reprezentatywne średnice kolonii. Należy zauważyć, że dane te są reprezentatywne dla hodowli pasażowanych w 7-dniowym odstępie pasażowania; należy spodziewać się mniejszych rozmiarów kolonii, jeśli stosuje się krótsze odstępy między pasażami.

Zdjęcie 5. W hodowlach mTeSR™ Plus obserwuje się normalną ludzką morfologię ES i komórek iPS
Obrazy przedstawiają niezróżnicowane ludzkie komórki hES (H1) i iPS (WLS-1C) hodowane na matrycy Corning® Matrigel® w mTeSR™1 (z codzienną wymianą podłoża) lub mTeSR™ Plus (odżywianie ograniczone). Komórki zachowują wyraźne jąderka i wysoki stosunek jądra do cytoplazmy charakterystyczny dla tego typu komórek po 10 pasażach. Gęsto upakowane komórki i wielowarstwowość są widoczne, gdy komórki są gotowe do pasażowania.
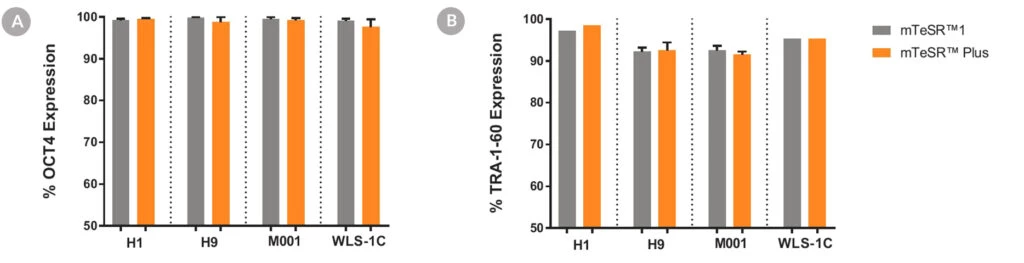
Wykres 6. Komórki hodowane w podłożu mTeSR™ Plus z ograniczonym planem żywieniowym wykazują ekspresję markerów charakterystycznych dla niezróżnicowanych komórek.
Ludzkie komórki ES (H1, H9) i iPS (WLS-1C, STiPS-M001) scharakteryzowano za pomocą cytometrii przepływowej dla określonych markerów komórkowych, (A) OCT3/4 i (B) TRA-1-60. Wykresy przedstawiają średnie wyniki ekspresji (± SEM) z dwóch dołków, co 5 pasaży, dla maksymalnie 10-15 pasaży w mTeSR™1 (codzienna wymiana pożywki) lub mTeSR™ Plus (odżywianie ograniczone).
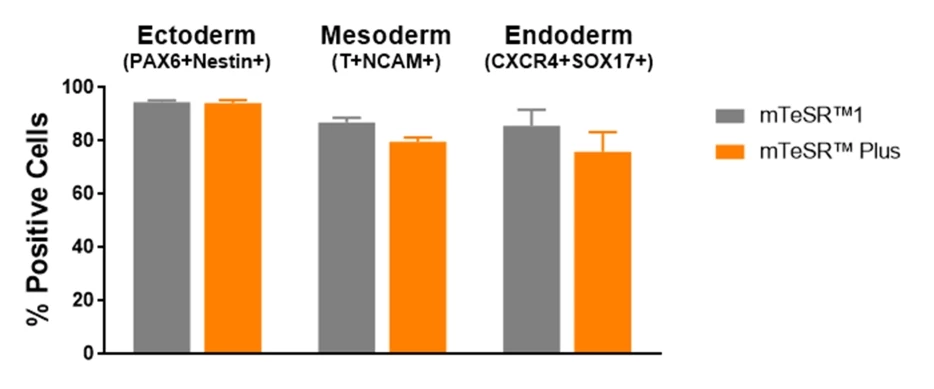
Wykres 7. Komórki utrzymywane w mTeSR™ Plus przy odżywianiu ograniczonym mają porównywalną skuteczność różnicowania do komórek utrzymywanych w mTeSR™1.
Ludzkie komórki ES (H1, H9) i iPS (WLS-1C, STiPS-M001) utrzymywano w mTeSR™1 (codzienna wymiana pożywki) lub mTeSR™ Plus (odżywianie ograniczone). Komórki różnicowano przy użyciu protokołów różnicowania ukierunkowanego i poddano analizie metodą cytometrii przepływowej. Wykresy przedstawiają średnie wyniki ekspresji (± SEM) z 4 linii komórkowych. Markery używane w cytometrii przepływowej dla każdego z listków zarodkowych są wymienione w tytułach słupków.
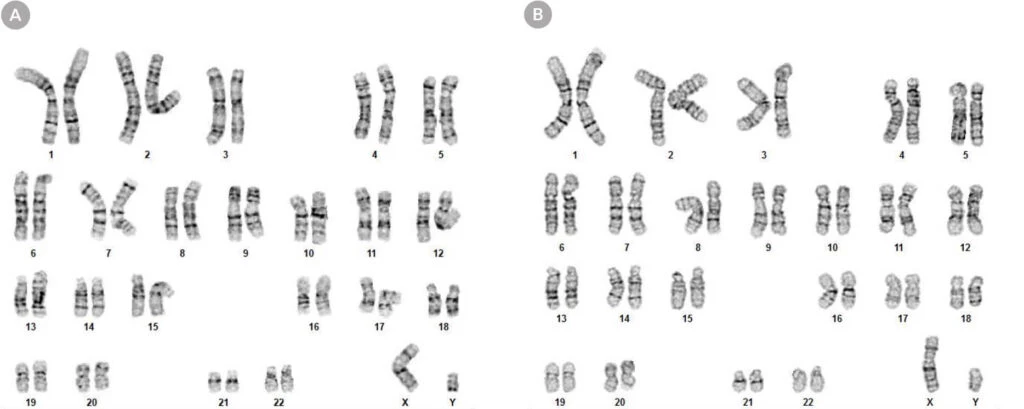
Rycina 8. Komórki hPSC hodowane w mTeSR™ Plus w planie ograniczonego odżywiania zachowują prawidłowy kariotyp
Kariogramy (A) ludzkich komórek ES (H1) i (B) iPS (WLS-1C) hodowanych w mTeSR™ Plus przez 30 pasaży pokazują, że zachowany jest prawidłowy kariotyp.
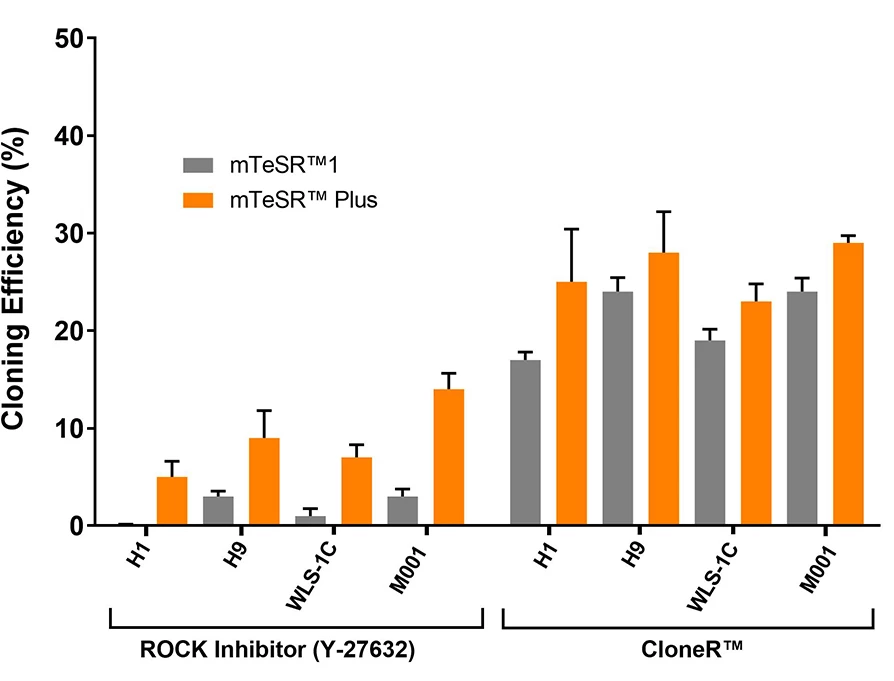
Wykres 9. Wysoka wydajność klonowania hPSC w mTeSR™ Plus suplementowanym CloneR™.
hPSC (H1, H9, WLS-1C i STiPS-M001) wysiane w mTeSR™ Plus z CloneR™ wykazują wydajność klonowania równą lub większą niż hPSC w mTeSR™1 z CloneR™. Komórki wysiano w gęstości klonalnej (25 komórek/cm²) w mTeSR™1 lub mTeSR™ Plus na płytkach CellAdhere™ pokrytych Vitronectin™ XF™. Powtórzenia n ≧ 3.
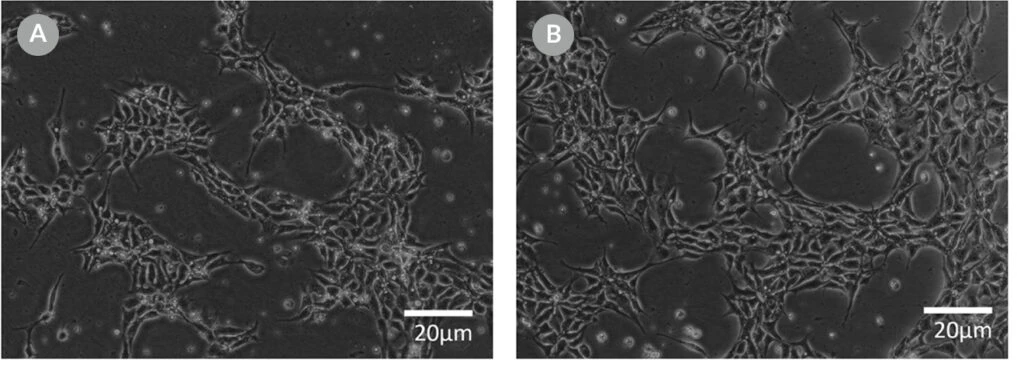
Zdjęcie 10. Reprezentatywna morfologia komórek 24 godziny po elektroporacji RNP w mTeSR™1 i mTeSR™ Plus
Komórki H1-eGFP ES wysiano w (A) mTeSR™1 i (B) mTeSR™ Plus i uzupełniono CloneR™ bezpośrednio po elektroporacji RNP. Obrazy wykonano 24 godziny po elektroporacji.
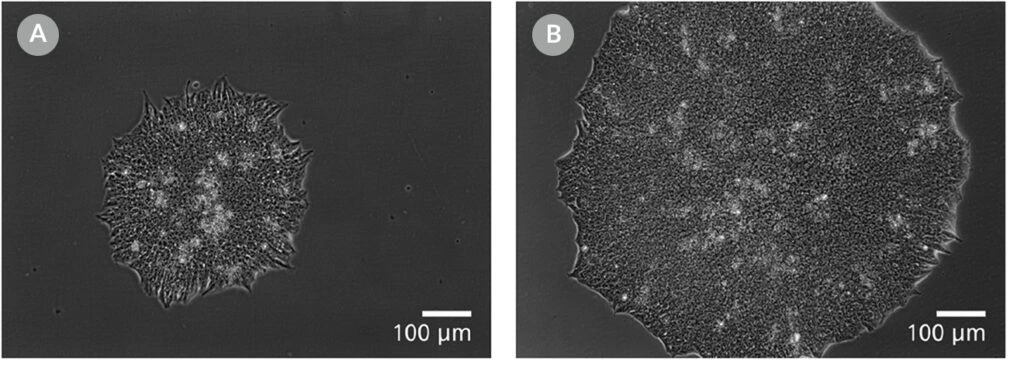
Zdjęcie 11. Klony pochodzące z mTeSR™ Plus są większe i gotowe do pobrania we wcześniejszym punkcie czasowym
Reprezentatywne obrazy kolonii ludzkich ES (H9) wykonane 8 dni po wysianiu pojedynczych komórek w gęstości klonalnej (25 komórek/cm²) w (A) mTeSR™1 lub (B) mTeSR™ Plus z dodatkiem CloneR™ na płytkach CellAdhere™ powlekanych Vitronectin™ XF™.
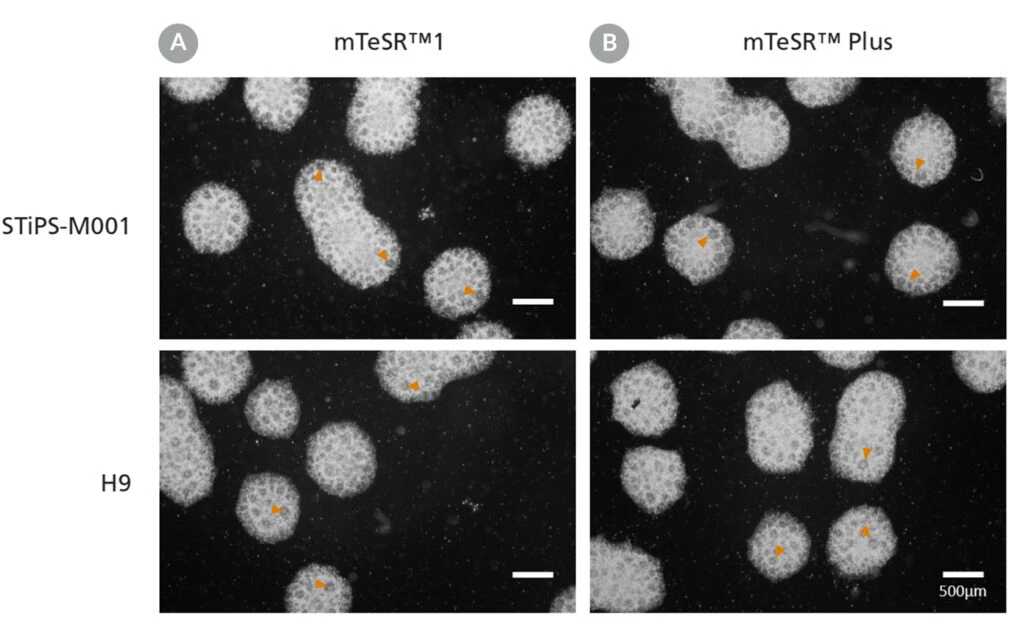
Zdjęcie 12. Generowanie neuronalnych komórek progenitorowych z hPSC utrzymywanych w mTeSR™ Plus
Ludzkie komórki ES (H9) i iPS (STiPS-M001) utrzymywano w (A) mTeSR™1 z codzienną wymianą pożywki lub (B) mTeSR™ Plus w planie ograniczonego odżywniania i różnicowano przy użyciu protokołu opartego na ciele zarodkowym (EB) z zestawem STEMdiff™ SMADi do indukcji neuronowej . Progenitorowe komórki nerwowe pochodzące z hPSC utrzymywanych w mTeSR™1 lub mTeSR™ Plus wyraźnie pokazują rozety nerwowe (groty strzałek) po ponownym wysianiu EB.
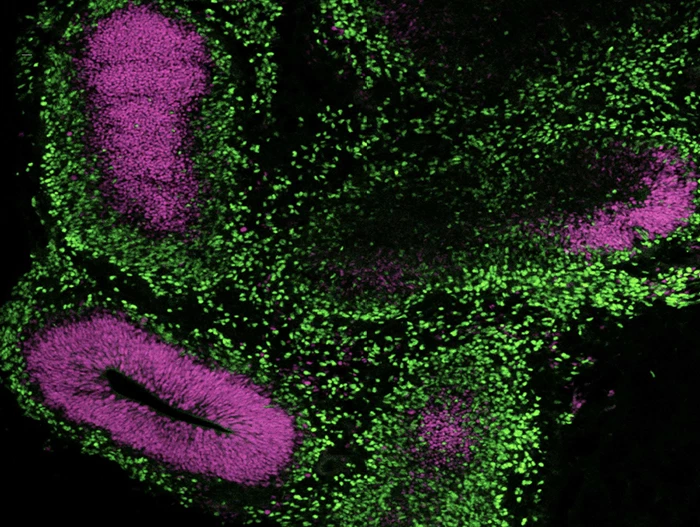
Rysunek 13. Generowanie organoidów mózgowych z hPSC utrzymywanych w mTeSR™ Plus
Ludzkie komórki ES (H9) hodowano w mTeSR™ Plus i kierunkowano do organoidów mózgowych przy użyciu zestawu STEMdiff™ Cerebral Organoid Kit. Zdjęcie przedstawia wierzchołkowy marker progenitorowy SOX2 (fioletowy) i neuronalny marker TBR1 (zielony).
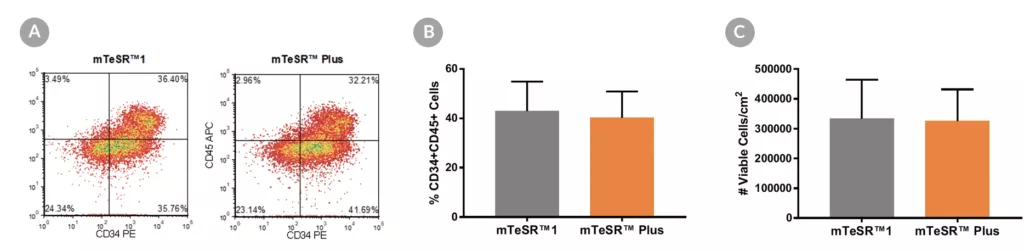
Rysunek 14. Generowanie hematopoetycznych komórek progenitorowych z hPSC utrzymywanych w mTeSR™ Plus
Ludzkie linie komórkowe ES (H1, H9) i iPS (STiPS-M001, WLS-1C) utrzymywane w mTeSR™1 (codzienna wymiana podłoża) lub mTeSR™ Plus (plan ograniczonego odżywiania) różnicowano do krwiotwórczych komórek progenitorowych przy użyciu zestawu STEMdiff™ Hematopoietic Kit. Pod koniec okresu różnicowania komórki zebrano z supernatantu i analizowano metodą cytometrii przepływowej pod kątem koekspresji CD34+ i CD45+. (A) Przedstawiono reprezentatywne wykresy gęstości pokazujące ekspresję CD34+ i CD45+, (B) procent komórek koeksprymujących CD34+ i CD45+ oraz (C) całkowitą liczbę zebranych żywotnych komórek. Dane wyrażono jako średnią (± SEM); n=4.
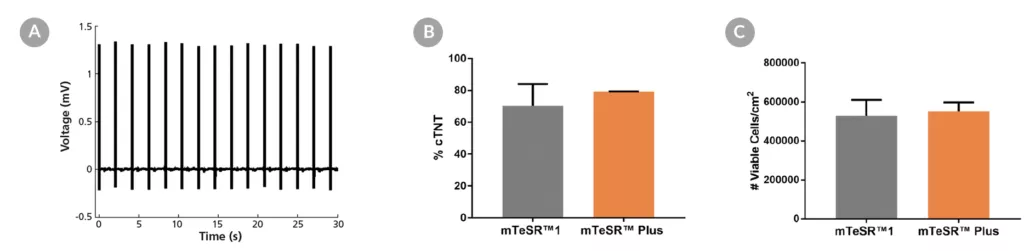
Rysunek 15. Generowanie kardiomiocytów z hPSC hodowanych w mTeSR™ Plus
Ludzkie komórki ES (H9) i iPS (WLS-1C) hodowano w mTeSR™1 (codzienna wymiana pożywki) lub mTeSR™ Plus (plan ograniczonego odżywiania) i różnicowano do kardiomiocytów przy użyciu zestawu STEMdiff™ Cardiomyocyte Differentiation Kit. Pod koniec okresu różnicowania komórki zbierano i analizowano za pomocą systemu MEA i cytometrii przepływowej. (A) Reprezentatywne zapisy napięcia MEA kardiomiocytów (dzień 20) wykazują charakterystyczny profil elektryczny i stabilną szybkość rytmu. (B) Pokazano procenty komórek wyrażających cTNT i (C) całkowitą liczbę zebranych żywych komórek. Dane wyrażono jako średnią (± SEM); n=2.
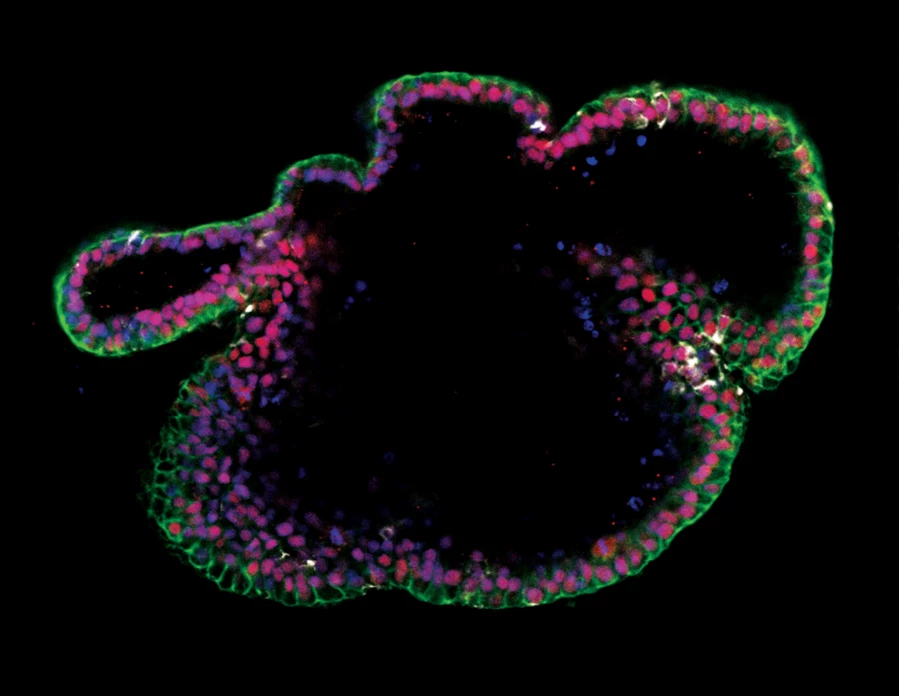
Zdjęcie 16. Generowanie organoidów jelitowych z hPSC hodowanych w mTeSR™ Plus
Ludzkie komórki ES (H9) hodowano z mTeSR™ Plus i różnicowano w kierunku organoidów jelitowych przy użyciu zestawu STEMdiff™ Intestinal Organoid Kit. Zdjęcie przedstawia markery nabłonka jelitowego EpCAM (zielony) i CDX2 (czerwony) oraz marker mezenchymatu jelitowego wimentyny (biały). Jądra są barwione kontrastowo DAPI (niebieski).
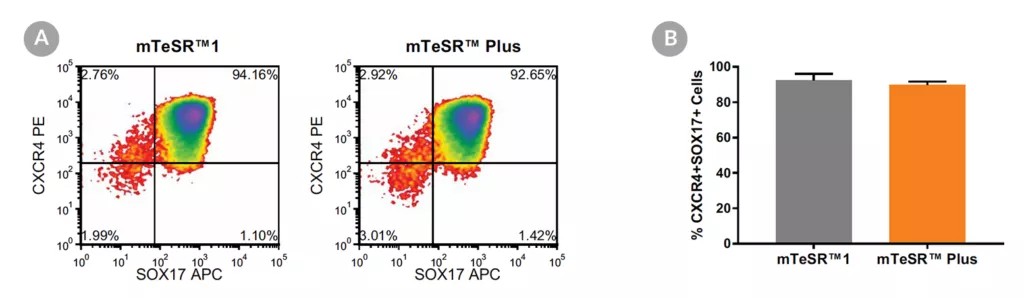
Wykres 17. Generowanie ostatecznej endodermy z hPSC hodowanych w mTeSR™ Plus
- (A) Reprezentatywne wykresy gęstości pokazujące ekspresję CXCR4 i SOX17 w komórkach hodowanych w mTeSR™1 (codzienna wymiana podłoża) lub mTeSR™ Plus (plan ograniczonego odżywiania), po 5 dniach różnicowania przy użyciu zestawu STEMdiff™ Definitive Endoderm Kit.
- (B) Analiza ilościowa tworzenia ostatecznej endodermy w wielu liniach hPSC (H9, STiPS-M001, WLS-1C) utrzymywanych z mTeSR™1 lub mTeSR™ Plus, mierzona przez koekspresję CXCR4 i SOX17. Dane wyrażono jako średni procent komórek (± SEM) wyrażających oba markery; n=3.
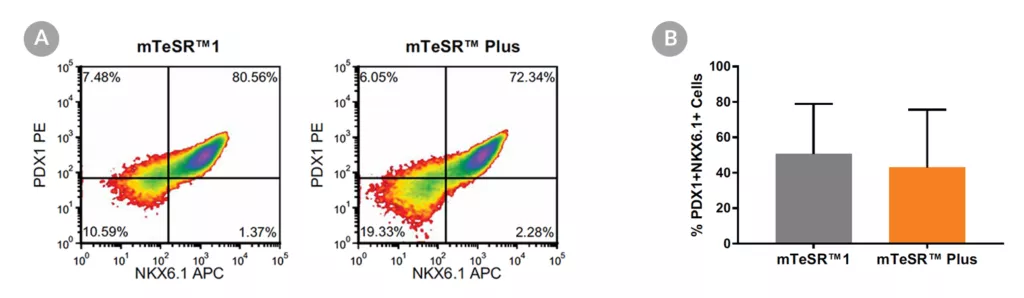
Wykres 18. Generowanie komórek progenitorowych trzustki z hPSC hodowanych w mTeSR™ Plus
- (A) Reprezentatywne wykresy gęstości pokazujące ekspresję PDX-1 i NKX6.1 w komórkach hodowanych w mTeSR™1 (codzienna wymiana podłoża) lub mTeSR™ Plus (plan ograniczonego odżywiania), po zróżnicowaniu przy użyciu zestawu STEMdiff™ Pancreatic Progenitor Kit.
- (B) Analiza ilościowa tworzenia komórek progenitorowych trzustki w wielu liniach komórkowych hPS (H9, STiPS-M001, WLS-1C) utrzymywanych z mTeSR™1 lub mTeSR™ Plus, mierzona przez koekspresję PDX-1 i NKX6.1. Dane wyrażono jako średni procent komórek (± SEM) wyrażających oba markery; n=3.
Materiały do pobrania: