Cayman LipiDOT Strips™: nowe narzędzie do badania interakcji białko-lipid
Interakcje między białkami i lipidami odgrywają różnorodne i złożone role w wielu procesach biologicznych, począwszy od struktury, funkcji i dynamiki błon biologicznych po interakcje gospodarz-patogen, metabolizm, transport i lokalizację oraz sygnalizację komórkową. 1-3 Podobnie jak w przypadku bardziej hydrofilowych ligandów, wiele białek ma miejsca wiązania lipidów i może z nimi specyficznie oddziaływać, modyfikując strukturę, konformację i składanie białek, wpływając na ich rekrutację, lokalizację i aktywację. 1,4,5 Interakcje białko-lipid scharakteryzowano jedynie dla niewielkiej liczby białek, jednak prawdopodobnie istnieje wiele innych białek wiążących lipidy, które nie zostały jeszcze odkryte. 1
Lepsze zrozumienie ważnej roli lipidów w modulowaniu funkcji białek poprzez identyfikację nowych interakcji lipid-białko może być przydatne w poszukiwaniu nowych możliwości terapeutycznych.
Praca z Cayman LipiDOT Strips™
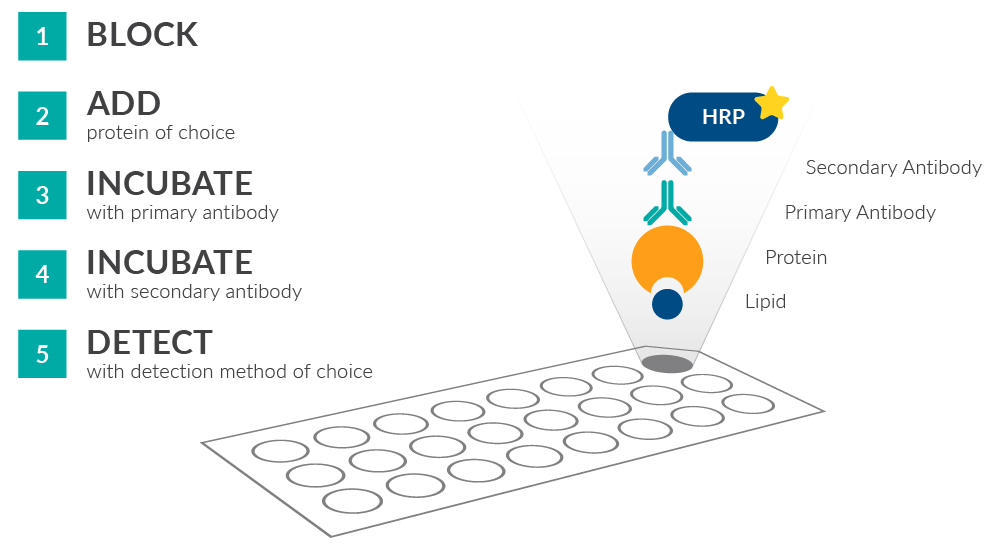
Paski Cayman LipiDOT™ służą do identyfikacji potencjalnych interakcji między docelowym białkiem, a 22 różnymi lipidami ułożonymi w formie wstępnie skonfigurowanego panelu. Przebieg pracy jest pod wieloma względami podobny do metody Western Blot. Test jest prosty w wykonaniu, tani i możliwy do przeprowadzenia w ciągu jednego dnia.
Paski Cayman LipiDOT™ blokuje się buforem blokującym i inkubuje z oczyszczonym białkiem będącym przedmiotem zainteresowania. Kolejno dodaje się przeciwciała skierowane przeciwko natywnemu białku lub odpowiedni znacznik powinowactwa, a następnie drugorzędowe przeciwciało niosące enzym reporterowy, aby umożliwić detekcję przy użyciu substratów chemiluminescencyjnych, fluorescencyjnych lub chromogennych. Wyniki testu wizualizuje się za pomocą standardowego sprzętu do obrazowania w oparciu o wybrany odczynnik detekcyjny.
Paski Cayman LipiDOT™ zawierają biologicznie istotne lipidy w tym fosfolipidy, cholesterol, a także diglicerydy i niektóre sfingolipidy.

Fosfolipidy błonowe są znane ze swojej roli głównego składnika błon, w których tworzą dwuwarstwę lipidową ze względu na swój amfipatyczny charakter. 6-9 Oprócz cholesterolu, głównego sterolowego składnika błon komórkowych ssaków, który oddziałuje z fosfolipidami błonowymi, lipidy oddziałują z białkami, wpływając na ich zachowanie.
Fosfatydyloinozytole (PI, znane również w literaturze jako PtdIns) to klasa fosfolipidów błonowych, które mogą ulegać fosforylacji w różnych pozycjach pierścienia inozytolu z wytworzeniem różnych fosforanów fosfatydyloinozytolu (PIP), rodziny lipidów błonowych, które działają jako kluczowe cząsteczki sygnalizacji komórkowej. 10 PIP uczestniczą w wielu reakcjach komórkowych, pełniąc funkcję markerów lokalizacji, analogicznie do biochemicznych kodów pocztowych, organizując białka komórkowe w określone miejsca i kierując ich działaniem poprzez specyficzne interakcje białko-lipid. PIP mogą również działać jako prekursory innych wtórnych przekaźników, jak w przypadku PIP2, który jest hydrolizowany przez fosfolipazę C z wytworzeniem IP3 i diacyloglicerolu (DAG). Cząsteczki DAG pełnią rolę wtórnych przekaźników i rekrutują do błon komórkowych kinazę białkową C (PKC), kluczową rodzinę enzymów odgrywającą rolę w wielu szlakach sygnałowych.
Inne lipidy błonowe można również przekształcić w lipidowe cząsteczki sygnalizacyjne, które kontrolują szereg dalszych reakcji, takich jak migracja, proliferacja i przeżycie komórek. 11,12 Lizoglicerofosfolipidy, w tym kwas lizofosfatydowy (LPA), lizofosfatydylocholina (LPC) lub lizofosfatydyloetanoloamina (LPE) powstają w wyniku katalizowanej przez PLA2 hydrolizy fosfolipidów błonowych. Bioaktywny sfingolipidowy sfingozyno-1-fosforan (S1P) jest strukturalnie podobny do LPA i może być również wytwarzany na błonach w wyniku hydrolizy sfingomieliny (SM), co powoduje uwolnienie aminoalkoholowej sfingozyny, która może być następnie fosforylowana przez kinazę sfingozynową co prowadzi do uzyskania S1P.
Paski Cayman LipiDOT™ – PIP Plus zawierają także sulfatyd i kardiolipinę (CL). Sulfatyd to siarczanowany glikosfingolipid, który odgrywa znaczącą rolę w układzie nerwowym. Występuje w dużych ilościach w osłonce mielinowej, bogatym w lipidy przedłużeniu błony komórkowej, który chroni aksony i pomaga w przekazywaniu impulsów elektrycznych między neuronami. 14 CL jest fosfolipidem i głównym składnikiem lipidowym wewnętrznej błony mitochondrialnej, odgrywającym rolę w bioenergetyce i dynamice mitochondriów. 15
Większość lipidów znajdujących się w paskach Cayman LipiDOT™ jest dostępna w sprzedaży jako osobne produkty. Narzędzia te są nieocenione w metodach uzupełniających Cayman LipiDOT Strips™, takich jak testy współsedymentacji i wspólnej flotacji liposomów. 9,13
Warto również zwrócić uwagę na znane białka wiążące lipidy, które można stosować jako kontrole pozytywne po inkubacji z oddzielnymi paskami Cayman LipiDOT™ wykonywanymi równolegle lub nakrapianymi na niebieskich pustych polach w ramach pojedynczego eksperymentu Cayman LipiDOT Strips™.
Białka, które mogą być przydatne jako kontrole pozytywne:
⦁ Białko wiążące PtdIns-(4,5)-P 2 – nr katalogowy 10009815
⦁ Białko wiążące PtdIns-(3,4,5)-P 3 – nr katalogowy 10009817
⦁ Aneksyna V (ludzka, rekombinowana) – nr katalogowy 20594
Bibliografia
1. Sych, T., Levental, KR i Sezgin, E. Interakcje lipid-białko w organizacji i funkcjonowaniu błony komórkowej. Annu. Ks. Biofizyka. 51, 135-156 (2022).
2. Corradi, V., Mendez-Villuendas, E., Ingόlfsson, HI i in. Interakcje lipid-białko są unikalnymi odciskami palców dla białek błonowych. Centrum ACS. Nauka. 4(6) , 709-717 (2018).
3. Zhao, H. i Lappalainen, P. Prosty przewodnik po biochemicznych podejściach do analizy interakcji białko-lipid. Mol. Biol. Komórka 23(15) , 2823-2830 (2012).
4. Bogdanov, M., Mileykovskaya, E. i Dowhan, W. Lipidy w składaniu białek błonowych i organizacji superkompleksów białkowych: implikacje dla zaburzeń związanych z lipidami. Podkomórka. Biochemia . 49 , 197-239 (2008).
5. Dowler, S., Kular, G. i Alessi, DR. Test nakładania lipidów białkowych. Nauka. STKE 129 , PI6 (2002).
6. Escribá, PV, González-Ros, JM, Goñi, FM i in . Błony: miejsce spotkań lipidów, białek i terapii. J. Cell. Mol. Med. 12(3) , 829-875 (2008).
7. Casares, D., Escribá, PV i Rossellό, CA Skład lipidów błonowych: wpływ na strukturę, funkcję i przedziały błon i organelli oraz możliwości terapeutyczne. Wewnętrzne J. Mol. Nauka. 20(9) , 2167 (2019).
8. van Meer, G., Voelker, DR i Feigenson, GW Lipidy błonowe: gdzie są i jak się zachowują. Nat. Wielebny Mol. Biol Komórkowy. 9(2) , 112-124 (2009).
9. Saliba, AE., Vonkova, I. i Gavin, A.-C. Systematyczna analiza interakcji białko-lipidy nabiera tempa. Nat. Wielebny Mol. Biol Komórkowy . 16(12) , 753-761 (2015).
10. Dickson, EJ i Hille, B. Zrozumienie fosfoinozytydów: rzadkie, dynamiczne i niezbędne fosfolipidy błonowe. Biochemia. J. 476(1) , 1-23 (2019).
11. Kano, K., Aoki, J. i Hla, T. Mediatory lizofosfolipidowe w zdrowiu i chorobie. Annu. Wielebny Pathol. 17 , 459-483 (2022).
12. zu Heringdorf, DM i Jakobs, KH Receptory lizofosfolipidowe: sygnalizacja, farmakologia i regulacja przez metabolizm lizofosfolipidów. Biochim. Biofizyka. Akta. 1768(4) , 923-940 (2007).
13. Senju, Y., Lappalainen, P. i Zhao, H. Liposomowe testy współsedymentacji i wspólnej flotacji w celu badania interakcji lipid-białko. Metody Mol. Biol . 2251 , 195-204 (2021).
14. Barnes-Vélez, JA, Aksoy Yasar FB i Hu, J. Mielinowy metabolizm lipidów i jego rola w mielinizacji i utrzymaniu mieliny. Innowacja (Camb) . 4(1) :100360 (2022).
15. Falabella, M., Vernon, HJ, Hanna, MG i in . Kardiolipina, mitochondria i choroby neurologiczne. Trendy Endokrynol. Metab. 32(4) :224-237 (2021).



